近日,由美国哈佛大学、耶鲁大学等机构进行的一项最新研究,通过表观遗传重编程(epigenetic reprogramming)技术,成功将动物的视觉衰老时钟逆转,该研究的成功也标志着首次证明可以安全地将复杂的组织(如视神经细胞)“返老还童”,即重新编程为更加年轻的状态。
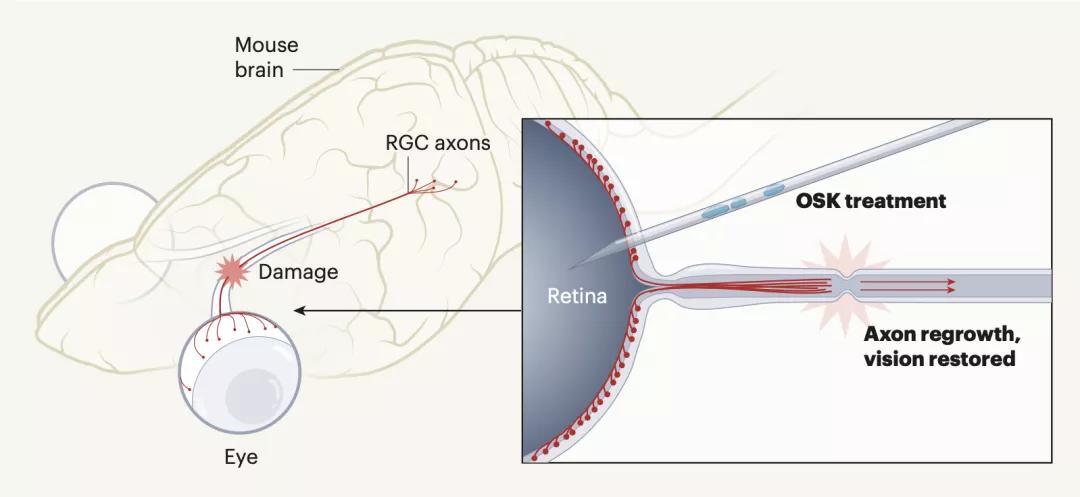
具体而言,研究人员对老年小鼠的视网膜细胞重新编程,使其重新获得年轻细胞的基因功能,让小鼠由衰老导致的受损视力重获新生,该研究还成功地逆转了青光眼所致的小鼠视神经损伤,并恢复它们受损的视力。
更重要的是,这一方法在眼睛以外的其它组织和器官的再生上,也得到了成功的验证,这也为人类治疗各种与年龄相关疾病奠定了坚实的基础。
该研究以 “Reprogramming to recover youthful epigenetic information and restore vision” 为题,于 12 月 3 日发表在最新一期《自然》(Nature)杂志上。
 图 | 最新一期 Nature 杂志封面(来源:Nature)
图 | 最新一期 Nature 杂志封面(来源:Nature)
研究人员表示,该研究首次成功地扭转了由青光眼引起的视力损失,而不仅仅是阻止其恶性发展。如果对该方法加以复制,必将为促进各种器官的组织修复铺平道路,并将逆转人类的衰老,解决与年龄相关的疾病。
逆转衰老时钟的技术
2006 年,日本京都大学山中伸弥领导的一个研究小组发现,通过将 4 个基因插入到成体细胞的 DNA 中,就能够使其变成多功能干细胞。山中伸弥也因这一重磅发现,而获得 2012 年诺贝尔生理学或医学奖。
一时间,人们对通过对成体细胞重编程产生诱导多能干细胞 (iPSCs),从而实现衰老组织或器官的再生,充满了无限想象。
但是,虽然理论上基因重编程能够使成熟体细胞细胞重回年轻状态,或发展成其它类型的细胞,但想要在复杂组织或器官中实现重编程过程,仍然是困难重重。
(来源:Nature)
而近几年,随着基因编辑技术的不断成熟,世界各地医学研究领域的研究人员也在不断探索利用基因重编技术造福病患的方法。
2012 年,《柳叶刀》(The Lancet)上发表的一项研究中,研究人员借助胚胎干细胞,成功地减轻了两名退行性失明患者的症状,让他们的视力得到一定程度的恢复,且无不良反应。
2014 年,英国牛津大学 Robert MacLaren 教授领导的研究团队在无脉络膜(Choroideremia)患者的视网膜上,通过重建有缺陷的基因让患者重见光明,该研究当时在英国医学界引起一阵轰动。
2020 年 4 月,中国科学家通过基因编辑技术,成功将实验小鼠大脑中的胶质细胞转分化为神经元,成功地恢复了小鼠因视神经节细胞死亡而造成的永久性视力损伤,该研究为进一步治疗神经退行性疾病提供了一个新路径。
2020 年 11 月 5 日,发表在 Nature 期刊上一篇题为 “ Protrudin function from the endoplasmic reticulum to support axon regeneration in the adult CNS ” 的文章中,科学家直接提取老鼠的视神经细胞,激活其再生机制,使眼睛中受损的神经细胞实现再生。
成功逆转和与年龄有关的视力丧失
失明对于一个人的影响不言而喻,据世界卫生组织此前公布的统计报告显示,全球视力受损人数高达 3.1 亿人,数目之大令人乍舌。而随着年龄的增长,因老年黄斑水肿、青光眼等眼底疾病导致的不可逆视神经损伤,更是会给许多人的生活带来极大的不便。
在可以导致人类失明的三大致盲眼病中,青光眼仅次于白内障,是一种不可逆的致盲眼病,总人群发病率达 1%。这种眼病是一种眼内压间断或持续升高的眼病,升高的眼压会对眼球各部分组织和视功能带来不可逆转的损害,最终悄悄偷走人的视力。
在该最新研究中,研究人员通过重编程技术,成功促进了小鼠受损视神经的再生,而且成功逆转了小鼠模拟人类青光眼疾病而造成的视力损失,更重要的是,该方法还逆转了没有青光眼的老年动物的视力损失。
(来源:Nature)
研究人员解释道,人体内的大多数细胞都含有相同的 DNA 分子,但功能却大不相同。为了实现差异化的功能,这些细胞必须只读取特异性的基因。这种调节功能也就是表观基因组的范畴,表观基因组即是在不改变基因的基本基础 DNA 序列的情况下,以特定模式开启和关闭基因的系统。
这一理论假设,随着时间的推移,表观基因组的变化会导致细胞读取错误的基因和功能失常,从而引起与衰老相关的疾病。随着年轻的增长,表观基因组最重要的变化之一就是 DNA 甲基化。随着时间的推移,DNA 甲基化的年轻模式消失了,细胞内本应开启的基因被关闭,反之亦然,从而导致细胞功能受损。
在这项研究中,研究人员假设,如果 DNA 甲基化确实控制了衰老,那么抹去它的一些足迹可能会逆转生物体内细胞的年龄,使它们恢复到更早、更年轻的状态。
在此之前科学家们在实验室培养皿中生长的细胞中实现了这一壮举,但未能在活体中证明这一效果。而这项研究结果表明,这种方法也可以在动物身上使用。
医学治疗领域将产生转变
实际上,山中伸弥发现通过 Oct4、Sox2、Klf4、c-Myc 这四个转录因子,可以抹去细胞上的表观遗传学标记,使这些细胞恢复到原始胚胎状态,从中可以发育成任何其他类型的细胞。
然而,随后的研究遭遇了两个重要的挫折:一是当在成年小鼠中应用山中发现的 4 种转录因子时,也可能诱导肿瘤生长,带来了不安全性;二是这些因子可以将细胞状态重置为最原始的细胞状态,但是也会完全抹去细胞的身份。
研究人员山中伸弥此前的研究基础上,通过稍微修改方法规避了这些障碍。他们舍弃了 c-Myc 基因,只传递了其余三个基因 Oct4、Sox2 和 Klf4 (OSK)。修改后的方法成功地逆转了细胞的老化,却没有助长肿瘤的生长或使它们丢失身份。
该研究的主要作者、HMS 遗传学研究员、曾在辛克莱实验室就读的博士生 Yuancheng Lu 表示,“项目开展之初,我们的许多同事都认为我们的方法会失败,或者太危险,亦或是永远不会被使用。但结果表明,这种方法是安全的,并有可能彻底改变眼睛,或治疗许多其他受老化影响的器官。”
研究人员表示,科学家很少能证明视觉丧失发生后如何恢复视觉功能,这种新方法,在不需要视网膜移植的情况下,成功逆转了由多种原因引起的小鼠视力丧失,代表了再生医学的一种新的治疗方式。
值得注意的是,该治疗方法在老年小鼠身上也同样发挥了良好的作用,而这些小鼠由于正常衰老而导致视力下降。这也就意味着,如果你把衰老时钟的指针往后绕,时间也会往后退。
该研究的作者之一、哈佛医学院 Blavatnik 研究所的遗传学教授,HMS 的 Paul F. Glenn 衰老生物学研究中心联合主任和衰老专家 David Sinclair 说:“ 我们的研究表明,有可能安全地逆转视网膜等复杂组织的年龄,并恢复其年轻的生物功能。”
但 Sinclair 及其同事也表示,在人类身上进行任何实验之前,这一发现仍有待进一步研究,还需要在不同的动物身上进行重复实验。尽管如此,这些结果为组织再生提供了一个概念证明,为设计与年龄有关的人类疾病提供了新的治疗途径。
“如果通过进一步的研究得到肯定,这些发现可能会对青光眼等年龄相关的视力疾病的护理以及对整个疾病的生物学和医学治疗领域产生转变。”Sinclair 说。
参考资料:
https://www.nature.com/articles/s41586-020-2975-4
https://news.harvard.edu/gazette/story/2020/12/reversing-glaucoma-damage-and-vision-loss/
作者 学术头条
更多阅读: