上周三,斯坦福大学Michael E. Belloy团队的研究,引起了极大的关注。
这项发表在著名期刊JAMA Neurology上的研究发现,散发型阿尔茨海默病(AD)最强风险基因APOE4对东亚人伤害最大,而且散发型AD最强保护基因APOE2也不保护东亚人[1]。APOE基因这种“厚此薄彼”的行为,着实伤了很多读者的心。
在那篇文章的留言中,有很多读者留言问我们APOE4在不同人群中的携带率。今天我们查了下相关的文献,发现首都医科大学宣武医院贾建平团队2020年的一篇论文中提及了相关数据,亚裔携带APOE4的频率为9%,西班牙裔为12%,白人为14%,非洲裔为19%[2]。
不难看出,虽然APOE4对东亚人伤害大,但是亚裔的APOE4携带率相对较低。这多少算是个好消息。
不过,我们今天就要给大家带来的是一个真正的好消息。
今日,由美国格拉德斯通研究所黄亚东领衔的研究团队,在著名期刊《自然·神经科学》发表了一项重磅研究成果[3]。
他们发现,在将2019年发现的家族性AD保护性突变APOE3 R136S[4]引入APOE4中之后,可以消除APOE4的毒性。具体来说,纯合的APOE4 R136S突变可完全防止APOE4驱动的Tau病理、神经变性和神经炎症。
由于APOE4是最强AD风险基因,且55%-75%的AD患者携带APOE4。因此,这项研究意味着,科学家已经吹响了围剿“最毒”基因APOE4的号角,为AD的治疗打开了新大门。
论文首页截图
关于APOE3 R136S的发现过程,我们这里就不再详述了。
在2019年,哈佛医学院等22所研究机构发现这个突变时,我们就做了深度报道,感兴趣的朋友可以点击超链接跳转回顾一下。
在黄亚东看来,APOE3 R136S突变的发现,对于阿尔茨海默病的治疗是个里程碑事件。不过当时的研究发现,它可以保护PSEN1-E280A携带者免受早发性AD的影响[4],对于这个突变是否可以消除APOE4的不良影响还无人知晓。
为了了解R136S突变对APOE4的影响,黄亚东团队分别在Tau病理小鼠模型(PS19)和人诱导多能干细胞(hiPSCs)中,研究了不同拷贝数APOE4 R136S对Tau病理的影响。
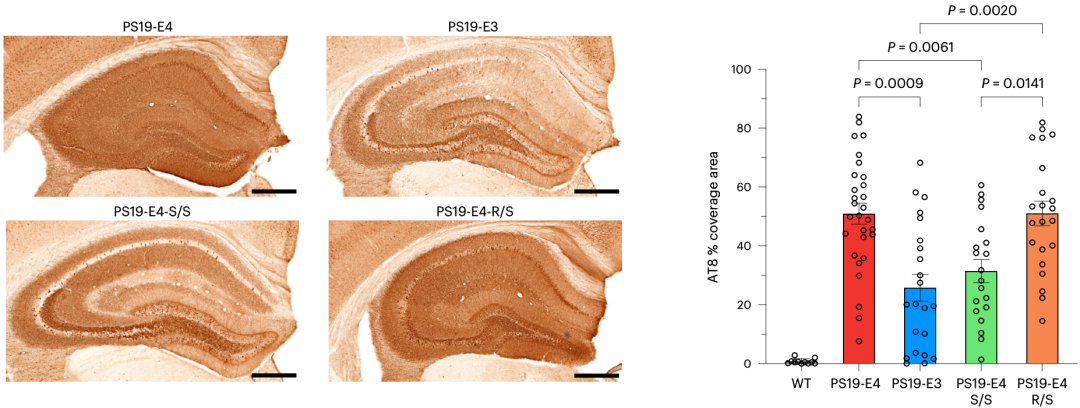
他们构建了PS19-E4(纯合APOE4)、PS19-E4-S/S(纯合APOE4 R136S)、PS19-E4-R/S(杂合)和PS19-E3(纯合APOE3)四种小鼠模型。在用AT8抗体标记不同小鼠模型大脑中p-Tau的积累水平时,他们发现PS19-E4小鼠的AT8阳性p-Tau覆盖面积是PS19-E3小鼠的两倍,PS19-E4-S/S小鼠的p-Tau水平与PS19-E3相当,PS19-E4-R/S小鼠的p-Tau水平未见减少。
纯合APOE4 R136S的保护作用初现
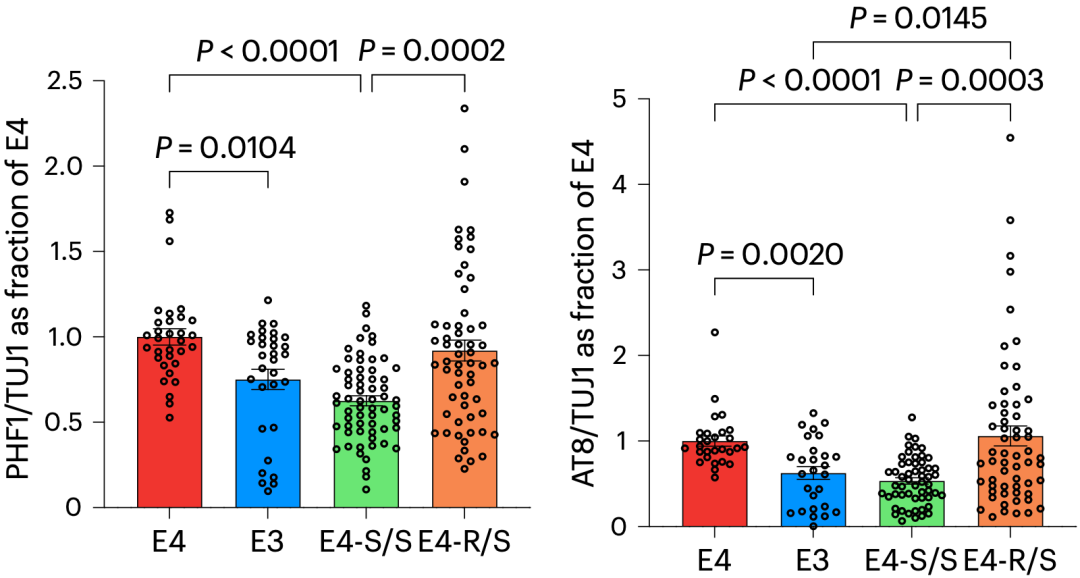
随后,基于APOE4纯合型AD患者的hiPSCs,黄亚东团队发现,在APOE4中引入R136S突变,会减少神经元中p-Tau的积累。
具体来说,与E4神经元相比,E3神经元的p-Tau水平显著降低;E4-S/S神经元的p-Tau水平降低了约40%;E4-R/S神经元的p-Tau水平没有下降。另一种检测方法也得到了类似的结论。
R136S对神经元Tau水平的影响
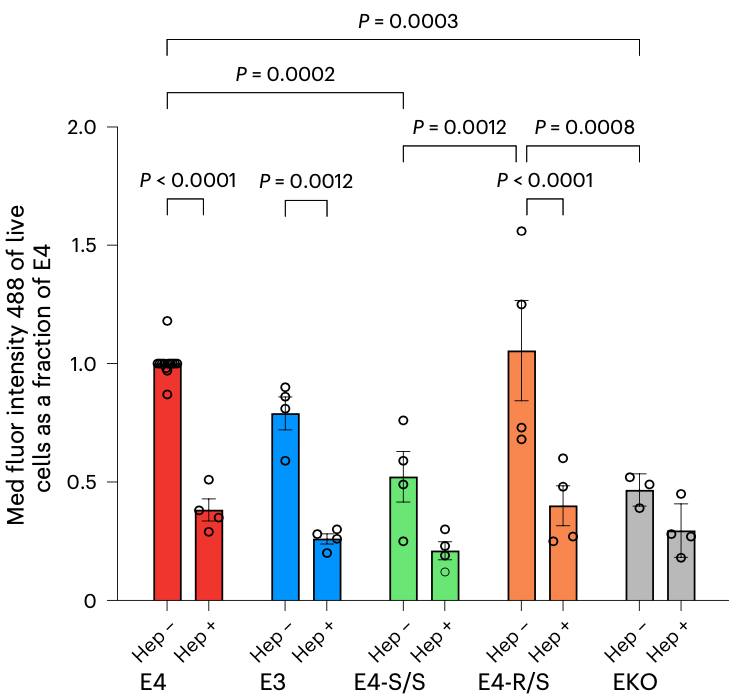
由于神经细胞对Tau蛋白的摄取是由硫酸乙酰肝素蛋白多糖(HSPGs)介导的,而在APOE4中引入R136S,会破坏HSPGs与APOE4蛋白的结合,进而导致神经细胞对Tau的摄入减少。
从数据上来看,如果用神经元的中位荧光强度(MFI)来反映单个细胞摄取Tau-488的中位水平的话,与E4神经元相比,E4-S/S神经元的MFI降低了约50%,表明Tau-488摄取减少;E3神经元也显示出Tau-488摄取减少约20%的趋势,但未达到统计学显著性;E4-R/S神经元的MFI没有显著差异。
黄亚东团队还注意到,APOE基因被敲除的细胞系(EKO)对Tau-488的摄取明显减少,大约只有E4-S/S神经元的水平。
以上数据说明,E4-S/S可减少人神经元对HSPG介导的Tau摄取,进而减少p-Tau在神经元中的积累。
R136S抑制Tau摄取
以上两个研究证实了R136S抑制Tau摄取和积累,接下来黄亚东团队探索了APOE4 R136S对小鼠模型Tau病理的影响。
在前面提及的四种小鼠模型10个月大时,黄亚东团队探索了小鼠大脑的病变情况。
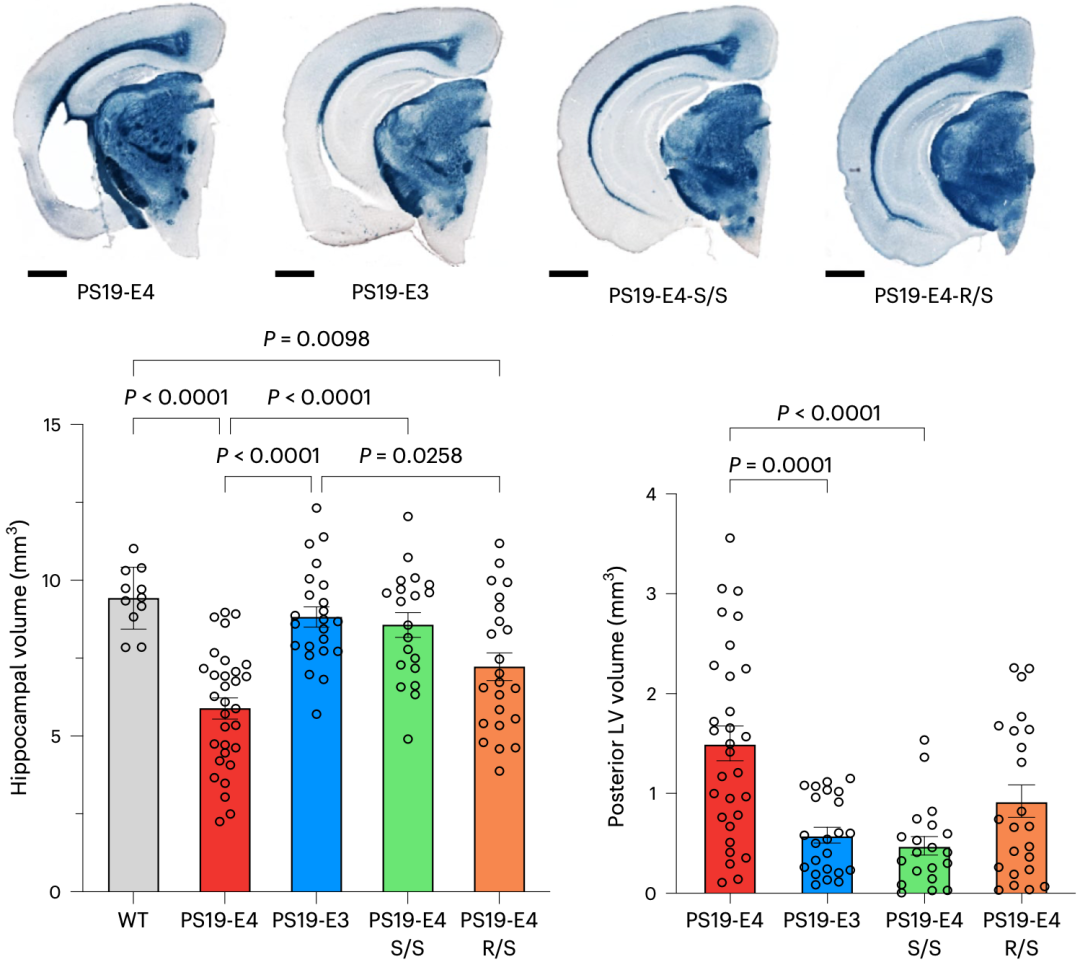
他们发现,与野生型小鼠和PS19-E3小鼠相比,PS19-E4小鼠的海马体积明显缩小。让他们吃惊的是,PS19-E4-S/S小鼠的海马萎缩程度与野生型小鼠和PS19-E3小鼠相似。PS19-E4-R/S小鼠的海马萎缩部分得到挽救,虽然没有达到PS19-E3的水平,但也接近了。不过,在所有小鼠6个月大的时候,它们的海马体积没有明显差异。
此外,与PS19-E3小鼠相比,PS19-E4小鼠的侧脑室明显增大,而PS19-E4-S/S小鼠的侧脑室没有扩大,PS19-E4-R/S小鼠的扩大幅度较小。
以上数据表明,R136S突变可改善Tau病理小鼠模型中APOE4驱动的神经退行性变,而且纯合突变是实现彻底拯救所必需的。
R136S对海马和侧脑室的影响
在研究的最后,黄亚东团队探索了APOE4 R136S对脑细胞的影响。
研究结果表明,APOE4 R136S会增加具有保护作用的神经元、星形胶质细胞和小胶质细胞亚群,并减少与疾病相关的少突胶质细胞、星形胶质细胞和小胶质细胞亚群,而且这种相关性具有基因剂量依赖效应。简单来说,纯合APOE4 R136S的作用最强。
总的来说,黄亚东团队这项研究成果证实,在APOE4的R136S突变具有保护作用,纯合APOE4 R136S甚至能完全抵消APOE4对Tau病理等的促进作用。
未来,有必要研究APOE4 R136S对Aβ病理以及小鼠模型认知的影响,以及阻断APOE4与HSPGs的结合,是否可以重现APOE4 R136S的效果。
治疗阿尔茨海默病的特效药,或许就藏在这个研究的背后。
参考文献:
[1].Belloy ME, Andrews SJ, Le Guen Y, et al. APOE Genotype and Alzheimer Disease Risk Across Age, Sex, and Population Ancestry. JAMA Neurol. 2023. doi:10.1001/jamaneurol.2023.3599
[2].Jia L, Xu H, Chen S, et al. The APOE ε4 exerts differential effects on familial and other subtypes of Alzheimer’s disease. Alzheimers Dement. 2020;16(12):1613-1623. doi:10.1002/alz.12153
[3].Nelson, M.R., Liu, P., Agrawal, A. et al. The APOE-R136S mutation protects against APOE4-driven Tau pathology, neurodegeneration and neuroinflammation. Nat Neurosci. 2023. doi:10.1038/s41593-023-01480-8
[4].Arboleda-Velasquez JF, Lopera F, O’Hare M, et al. Resistance to autosomal dominant Alzheimer’s disease in an APOE3 Christchurch homozygote: a case report. Nat Med. 2019;25(11):1680-1683. doi:10.1038/s41591-019-0611-3
来自: 奇点神思
更多阅读: