著名的生物学家拉马克曾提出“用进废退”原则,也就是生物体的器官经常使用就会变得发达,而不经常使用就会逐渐退化。但是这一原则在冬眠的生物中似乎并不适用。
冬眠的熊一年中可以在它们的窝里静卧五到七个月,却能无损的度过整个冬眠期。但是在人类中,仅仅三周不活动就会导致肌肉质量下降,并且随着时间推移,还会导致与久坐不动的生活方式相关的疾病,如肥胖和糖尿病,甚至导致更早死亡。
日本科学家观察发现人类骨骼肌细胞中注入冬眠熊血清会使肌肉增加,证明冬眠这些动物血液中激活了独特因子因而触发了它们在不活动的好几个月也能防止肌肉萎缩的显著能力。
日本广岛大学在《PLOS ONE》杂志中发表的一篇研究《Supplementing cultured human myotubes with hibernating bear serum results in increased protein content by modulating Akt/FOXO3a signaling》提出冬眠熊的血清通过调节 Akt/FOXO3a 信号传导增加蛋白质含量可以补充人类的肌管。
黑熊冬眠时以最小的骨骼肌萎缩和代谢来维持身体机能,研究人员认为黑熊冬眠期间对骨骼肌萎缩的抵抗可能是由与神经肌肉活动无关的季节性变化介导的。
为了确定熊血清中是否存在调节蛋白质和能量代谢的成分,研究人员收集了同一只黑熊在活跃的夏季(7 月)和冬眠期间(2月)的血清分别用于处理分化的人类骨骼肌细胞。
研究结果发现在与黑熊血清一起培养24h后的人类骨骼肌细胞并没有发生任何形态变化,以及分化的人肌管中细胞核数量也没有增加。但是与活跃夏季熊血清相比(ABS),冬眠期熊血清(HBS)处理的人类骨骼肌细胞总蛋白含量显著增加。
(图片来源:参考资料1)图1 培养的人骨骼肌细胞中总蛋白含量的变化:夏季活跃期与冬眠期。
由于本研究中使用了完全分化的肌管,因此蛋白质含量的变化基本上可以反映蛋白质合成与降解的平衡。鉴于前面的结果,接下来研究人员决定检查骨骼肌中蛋白质合成的重要调节成分——蛋白激酶B(Akt)的激活状态和雷帕霉素复合物1(mTORC1) 途径的机械靶点。
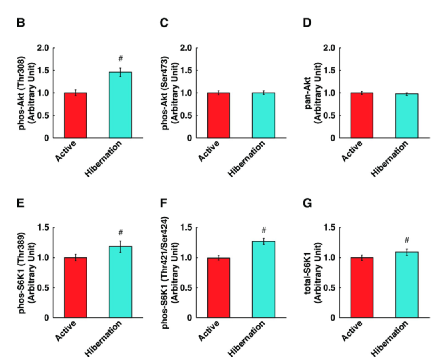
进一步的研究发现,尽管HBS诱导了Akt/mTORC1通路的激活,但这并不会直接诱导人的骨骼肌细胞蛋白质合成。与 ABS相比,用HBS处理后培养的肌管中Akt在Thr308处的磷酸化(Akt激酶活性的指标)显著增加,此外,mTORC1活性的直接下游靶点S6K1的磷酸化在位点Thr389(图2E)和Thr421/Ser424(图2F)显著增强。S6K1的总蛋白表达也增加(图2G),但Ser473位Akt的磷酸化和pan-Akt的表达水平没有改变(图2C和2D)。
(图片来源:参考资料1)图2 冬眠熊血清增强培养的人骨骼肌细胞中的 Akt/mTORC1 信号传导
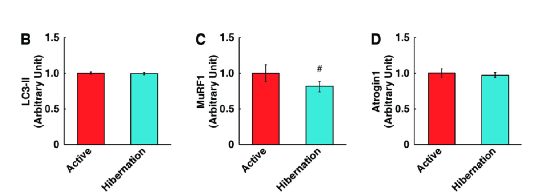
蛋白合成如果没有影响,研究人员又把关注点聚焦在蛋白的降解。HBS是否会阻止蛋白的降解来增加蛋白总量呢?骨骼肌已知有两条主要的蛋白降解途径:自噬–溶酶体系统和泛素–蛋白酶体系统。结果发现肌肉环指蛋白-1(MuRF1)蛋白——一种肌肉萎缩的已知标志蛋白的表达在HBS治疗后显著降低(图2C),表明人骨骼肌细胞通过泛素–蛋白酶体依赖系统的蛋白质降解受到了抑制。
(图片来源:参考资料1)图2 冬眠熊血清导致培养的人骨骼肌细胞中蛋白水解系统的蛋白质表达减少
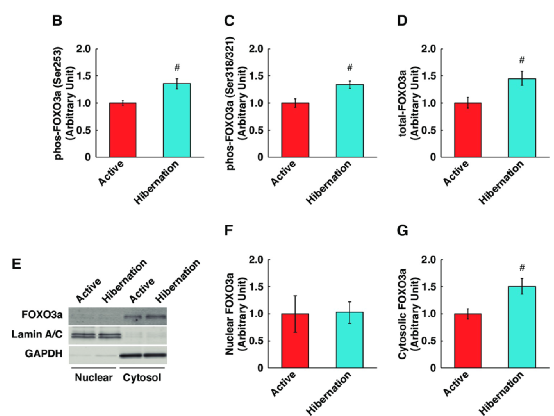
通过泛素–蛋白酶体系统降解蛋白有一种潜在的调节机制——Akt-FOXO轴调控,并且MuRF1也是FOXO3a转录活性的潜在靶点。研究人员进一步探究了HBS对Akt-FOXO轴调控的影响,发现与ABS相比,HBS处理后FOXO3a的磷酸化和总表达显著增加(图3B-3D),并且只有胞质FOXO3a显著增加,而核FOXO3a没有变化(图3E-3G)。结果表明了HBS促进了胞浆部分FOXO3a蛋白的磷酸化和分离,这可能导致FOXO3a转录活性降低。
(图片来源:参考资料1)图3 冬眠熊血清增加培养的人骨骼肌细胞中 FOXO3a 的磷酸化和胞质锚定。
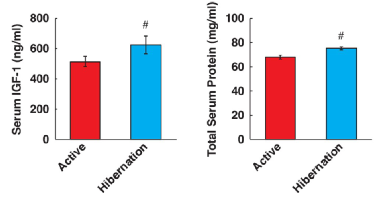
骨骼肌Akt-FOXO3a轴激活的候选上游因子是IGF-1,它是一种血清生长因子。研究人员用ELISA法测定了血清IGF-1水平,发现冬眠期间血清IGF-1含量显著高于夏季活动期 (图4A),这样就可以说明是由于IGF-1含量的升高,影响了骨骼肌细胞中Akt-FOXO3a途径,导致FOXO3a转录活性的潜在靶点MuRF1表达减少。相应的,冬眠熊血清中的总蛋白含量也显著增加(图4B)
(图片来源:参考资料1)图4 夏季活跃期与冬眠期熊血清中IGF-1浓度和总蛋白含量
该研究仍有一个尚未解决的难题,那就是除了IGF-1外,HBS中还有哪些成分会影响骨骼肌的蛋白质代谢呢?在之前的研究报告提到,IGF-1在熊的血清表现出季节性变化,在夏季活动期间最高,在冬眠早期最低,然后在冬眠结束时再次上升,故很难确定血清IGF-1是否在维持培养的骨骼肌细胞中的蛋白质含量方面起作用。
“我们已经表明,冬眠熊血清中存在的‘某些因素’可能会调节培养的人类骨骼肌细胞中的蛋白质代谢,并有助于维持肌肉质量。然而,这种‘因素’的鉴定尚未实现。”本研究的作者Miyazaki提到。
如果能够通过识别冬眠熊血清中的这个‘因素’,并阐明冬眠动物即使不使用肌肉也不会减弱这个现象背后的机制,就有可能在人类中制定有效的康复策略,以防止未来卧床不起。这将给肌肉萎缩的患者带来福音,让我们一起拭目以待吧!
参考资料
1.https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0263085
更多阅读: