早在1925年,科学家Otto Heinrich Warburg便发现大多数肿瘤细胞依赖有氧糖酵解为自身代谢供能(Warburg效应),而正常分化的细胞主要依靠线粒体的氧化磷酸化(TCA循环)或无氧糖酵解为细胞供能。然而,癌性肿瘤细胞在哺乳动物体内生长究竟需要消耗多少能量始终困扰着科学家们。他们假设肿瘤能消耗大量能量,可以迅速代谢营养物质,进而使心脏、肝脏、胰腺等健康组织在代谢营养物质时处于不利地位。
但一项最新发表在《Nature》的研究中,来自普林斯顿化学和路德维希普林斯顿分院(Princeton Chemistry and the Ludwig Princeton Branch)的Joshua Rabinowitz研究团队首次证明事实恰恰相反:肿瘤将营养物质转化为可被利用的细胞能量的过程十分缓慢。这种迟缓或许有助于肿瘤保存能量以完成更大范围的增殖和扩散等任务 【1】。

他们利用同位素示踪剂输注、质谱 (MS) 以及对所得代谢物标记数据进行定量建模的方法,开发并验证了一种测量小鼠组织和肿瘤中的 TCA 循环通量的策略。还使用 2-脱氧葡萄糖输液量化了葡萄糖的使用通量。以上方法表明,健康小鼠的组织使用 TCA 循环和氧化磷酸化产生至少 90% 的 ATP。而原发性实体瘤则对TCA表现出明显的抑制作用 ,但仍通过氧化的方法产生大部分 ATP ,说明实体瘤的总 ATP 生成率大大低于健康器官。
原发性实体瘤中TCA 循环受抑制
转移瘤TCA循环高度活跃
首先,研究人员建立了小鼠组织能量代谢的系统级图谱。基于代谢通量等于分子通过代谢途径的周转率的定义,TCA 通量指引入标记底物时标记分数上升的初始速率与TCA通路中代谢物总和的乘积。那么,该选哪种代谢物来标记呢?在不同的组织中,乳酸是 TCA 循环的主要燃料且可以快速进入组织。因此,通过在小鼠体内静脉注射 [U-13C] 标记的乳酸并在不同时间点进行测量,TCA 代谢物被标记的速度可以反映TCA 通量。
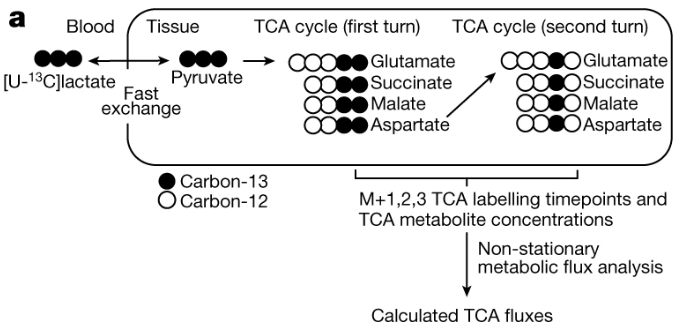
图注:TCA 通量测量方法流程图【1】
研究人员将TCA 通量测量方法应用于小鼠的几种癌症模型中,发现与健康组织相比,肿瘤有着更低的TCA通量。在5个原发性实体瘤模型中,通过注射 [U-13C] 乳酸或[U-13C] 谷氨酰胺进行测量的 TCA 通量低于几乎所有健康组织的通量。例如,在基因改造小鼠(Kras 突变和 Trp53 缺陷)胰腺肿瘤模型(GEMM PDAC)以及皮下植入胰腺肿瘤小鼠模型(Flank PDAC)中,TCA 通量均比健康胰腺慢6倍。肺癌模型和结肠癌模型也观测到相似的结果。与实体瘤中的低 TCA 通量相反,NOTCH1 驱动的 T 细胞急性淋巴细胞白血病的可移植小鼠模型显示出与健康小鼠脾脏相比高约3倍的 TCA 通量。因此,与健康组织相比,小鼠原发性实体瘤而非白血病具有较低的 TCA 通量。此结果与Warburg效应一致。
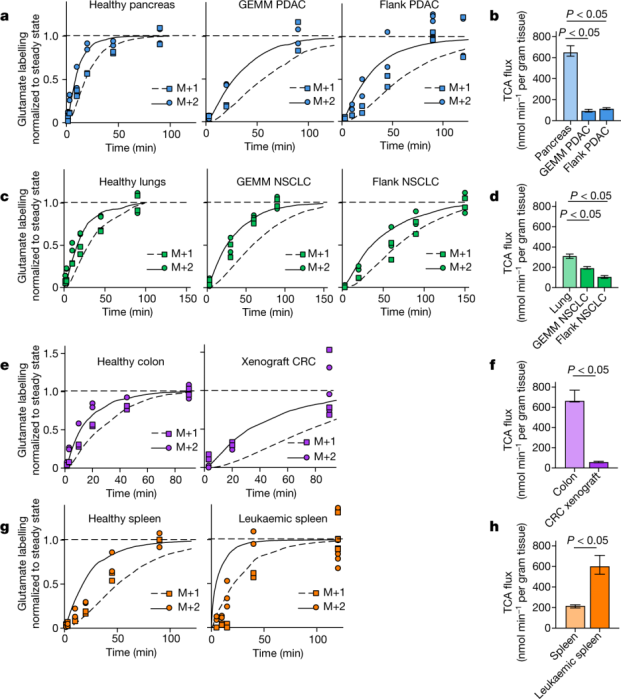
图注:TCA通量在健康小鼠组织和胰腺癌、肺癌、结肠癌和T 细胞急性淋巴细胞白血病小鼠模型中的对比【1】
TCA通量在转移瘤中的情况又如何呢?肿瘤的转移需要癌细胞迁移出组织,在血液或淋巴液中存活,并在新的组织生态位中立足。之前的研究表明,转移癌细胞活性氧(ROS)水平升高,而这可能是由电子传输链产生的。为了测量小鼠体内转移瘤的TCA通量,研究人员利用2种转移到肺部的原位乳腺癌异种移植小鼠模型进行实验。他们发现在这两种模型中,与原发性肿瘤和周边健康的肺部组织相比,转移定植的肺具有更高的 TCA 通量。
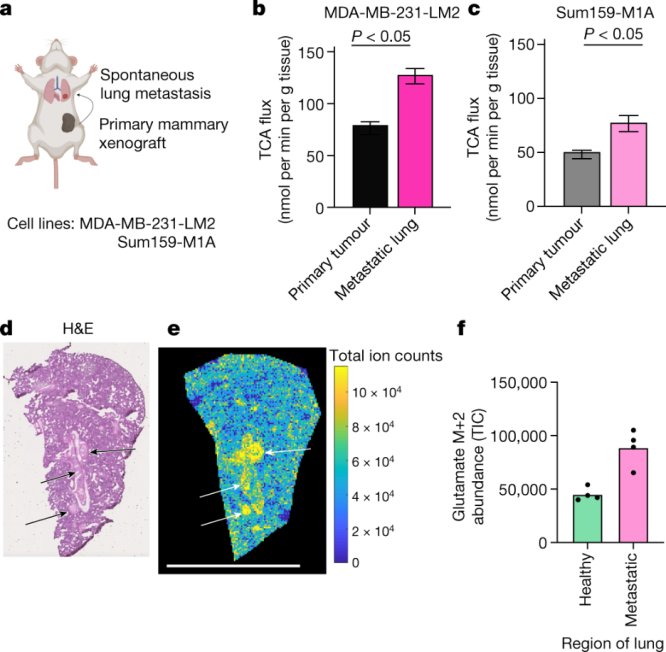
图注:肺转移瘤比原发性肿瘤具有更高的 TCA 通量【1】
肿瘤产能速度慢
尽管实体瘤的TCA通量低于健康组织,它们可能通过高水平的糖酵解进行弥补以达到高产能水平。为了精确测量细胞葡萄糖通量,研究人员向小鼠注射了[1-13C] 标记的2-脱氧葡萄糖。2-脱氧葡萄糖可以被葡萄糖转运蛋白吸收进入细胞并被磷酸化,但无法被进一步代谢。
利用葡萄糖通量和TCA通量的数据,研究人员计算了ATP合成的总速率。他们发现在胰腺癌、肺癌和结肠癌的实体瘤模型中,与相应的健康组织相比,小鼠原发性实体瘤产生 ATP 的速度更慢。进一步的研究发现,与健康组织相比,肿瘤从糖酵解中获得了更高比例的 ATP。但尽管如此,大多数 ATP 在每种组织和肿瘤类型中都是通过氧化产生的。因此,与大多数健康组织相比,小鼠体内的实体瘤产生和使用 ATP 的速度更慢,这与肿瘤通常代谢亢进的看法相悖。不过,这种方法无法区分肿瘤是由于代谢需求低还是由于 ATP 生产能力低(例如,由于营养物质可用性有限)而导致 ATP 生成缓慢。
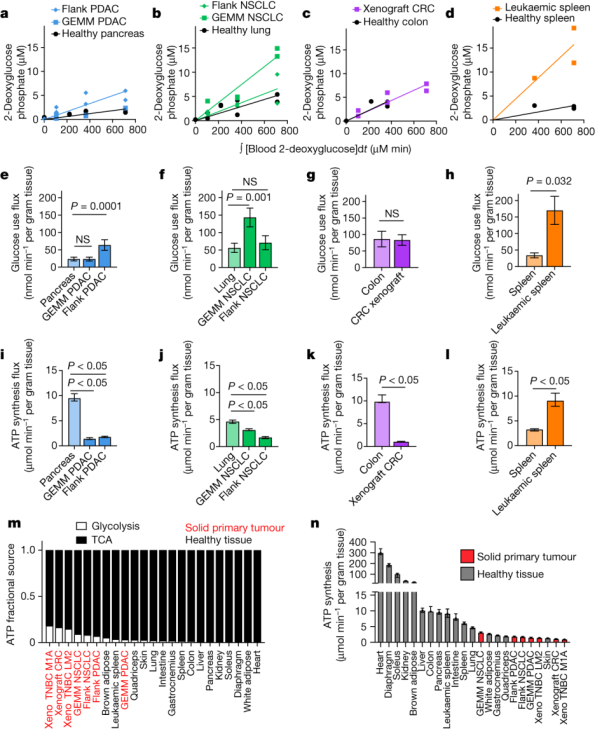
图注:肿瘤合成ATP速度低于健康组织【1】
肿瘤是如何在利用较少ATP的情况下实现扩增的呢?研究人员进一步调查了主要有ATP消耗功能的通路,包括胰腺中的酶分泌和脂肪消化,肾脏对碳酸氢盐和钠的再回收,以及肝脏中的糖异生和糖原代谢等功能通路。他们发现与健康组织相比,这些通路中的基因表达在肿瘤中都明显下调。在肝脏和肾脏中,这些基因的较低表达可能会导致编码的酶和离子泵消耗较少的 ATP;而在胰腺中,ATP 的节省则是通过减少外分泌酶的合成来实现的。这些数据表明实体瘤下调了组织特有的消耗 ATP 的功能,从而节省了 ATP 消耗以支持增殖。
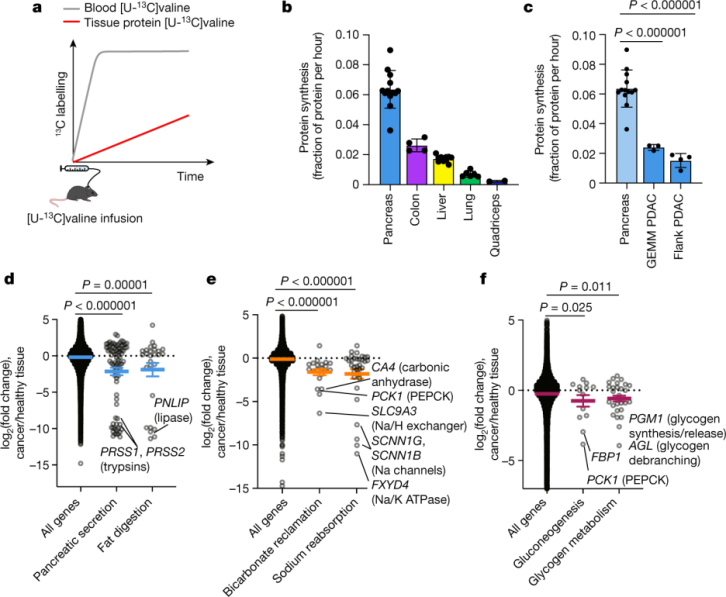
图注:肿瘤下调消耗 ATP 的组织活动【1】
综上所述,在五种不同类型的癌症中,研究小组发现肿瘤在低能量预算下成功增殖,部分原因是它们忽视了健康器官为整个身体的利益而执行的正常组织功能。Rabinowitz 表示, “肿瘤正面临着严酷的代谢环境,它们没有利于身体其他部位发育的脉管系统。因此它们被迫用更少的东西来凑合。”
这一发现对抗癌策略具有重大意义,因为它将我们的注意力引向了减缓能量代谢。一些针对癌症患者提出的治疗方法围绕着“饥饿疗法”“饿死肿瘤”策略,假设没有营养素肿瘤就无法生长,现在看来是值得怀疑的。因为随着实体瘤的进展,在产生ATP能量有限的情况下仍能促进癌细胞的失控生长。
参考文献:
【1】 Bartman, C.R., Weilandt, D.R., Shen, Y. et al. Slow TCA flux and ATP production in primary solid tumours but not metastases. Nature (2023). https://doi.org/10.1038/s41586-022-05661-6
来自: 生物谷
更多阅读:

