痛觉感受器真是一个神奇的存在。
作为一种痛觉感受神经元,科学家很早就发现它与人体免疫存在千丝万缕的联系,可以调节免疫反应。
就在上个月初,哈佛医学院的研究人员发现,细菌在感染大脑的时候,会激活疼痛神经元,抑制大脑免疫,促进感染[1]。所以,咱们头疼欲裂的时候,有可能就是细菌正在穿越脑膜。
如果仅从上面那个研究来看,痛觉神经元被激活似乎不是什么好事儿。然而,我们要是这样看待痛觉神经元的激活的话,恐怕就冤枉了好人。
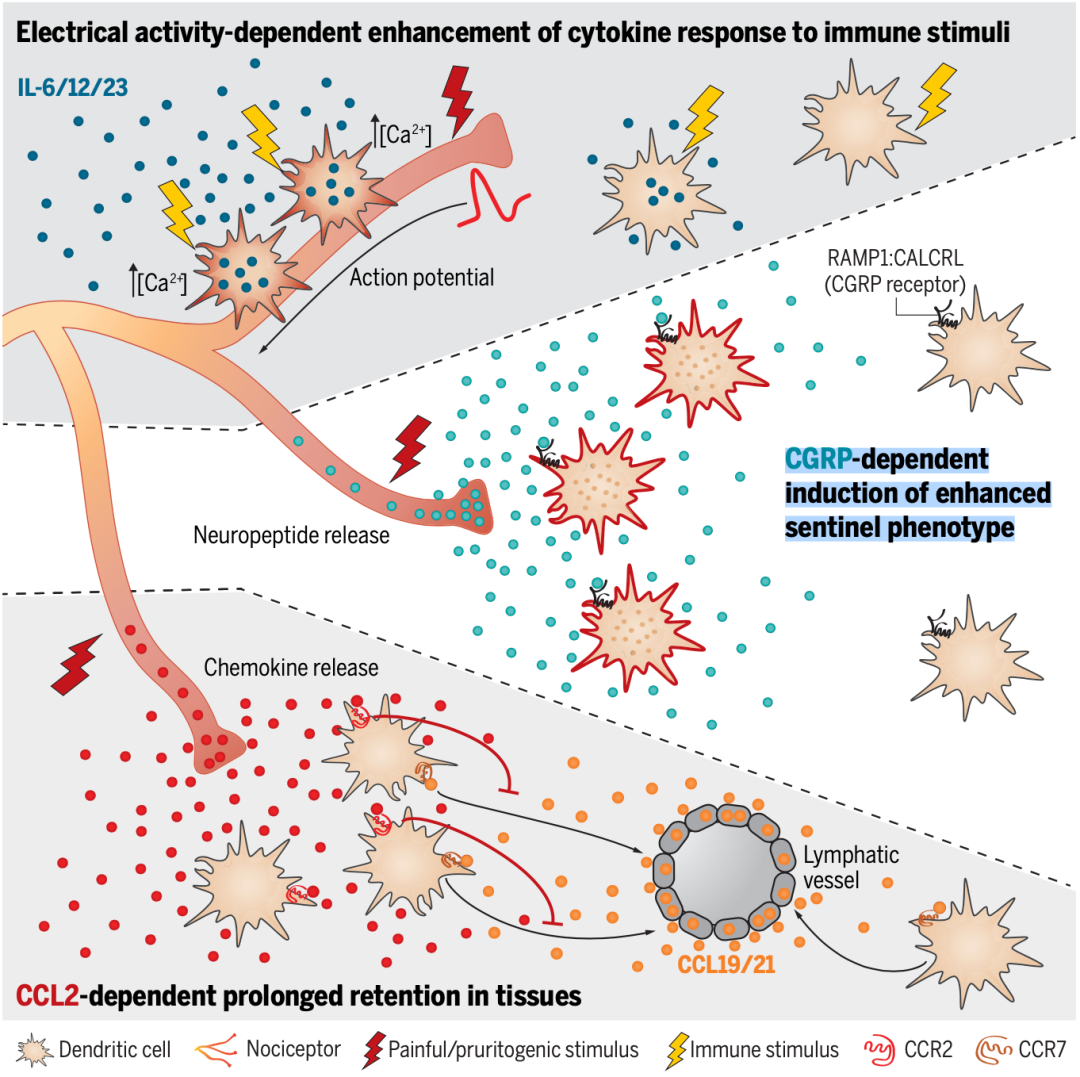
就在上周,由哈佛医学院神经学家Ulrich H. von Andrian领衔的研究团队,在顶级期刊《科学》上发表重磅研究成果[2],发现痛觉感受器调节树突状细胞(DCs)免疫反应的三种方式。
具体来说:第一,被有害刺激激活的痛觉感受器会产生趋化因子CCL2,吸引树突状细胞靠近,并调节它们在组织中停留的时间;第二,树突状细胞一旦与活跃的痛觉感受器接触,二者之间就会发生电耦合,增强树突状细胞的促炎症细胞因子反应;第三,痛觉感受器被激活后,还会释放神经肽——降钙素基因相关肽(CGRP),促进树突状细胞表达抵抗病原体和哨兵功能相关的基因。
简单来说,遍布人体的痛觉神经元在感知到异常之后,会召集免疫系统的“哨兵”——树突状细胞,并让其提高警惕。
论文首页截图
痛觉感受器是遍布屏障器官(皮肤和粘膜)的感觉神经元,在检测到机械损伤、反应性化学物质、炎症介质和病原体等有毒有害刺激后,它能将这些刺激以疼痛或瘙痒的感觉转达给大脑,同时释放神经肽,影响免疫细胞[3]。
在人体的屏障组织中,也广泛分布着免疫系统的“哨兵”——树突状细胞。这些哨兵白细胞能感知病原体的存在,在抗原呈递和适应性免疫的调节中发挥关键作用。
已经有研究发现,真皮中的树突状细胞紧密地聚集在痛觉感受器周围,而且这对树突状细胞的功能有深刻的影响[4,5]。然而,虽然这些观察结果表明二者之间可能存在直接交流,但目前仍不清楚二者是如何互动并调节免疫的。
为了解决上述难题,von Andrian团队从小鼠身上分离了初始背根神经节神经元和骨髓,分别在特定条件下培养成痛觉感受器和树突状细胞。随后,他们将痛觉感受器和树突状细胞共培养。
他们发现,在共培养基中加入能同时激活痛觉感受器和树突状细胞的物质,例如TLR7激动剂咪喹莫特(IMQ)、TLR2/Dectin-1激动剂酵母聚糖、TLR4激动剂脂多糖(LPS)和TLR5激动剂鞭毛蛋白,就能提升树突状细胞产生炎症细胞因子的能力。如果不激活痛觉感受器,就没有这种增强作用,而且将树突状细胞与其他神经元共培养没有这样的效果。
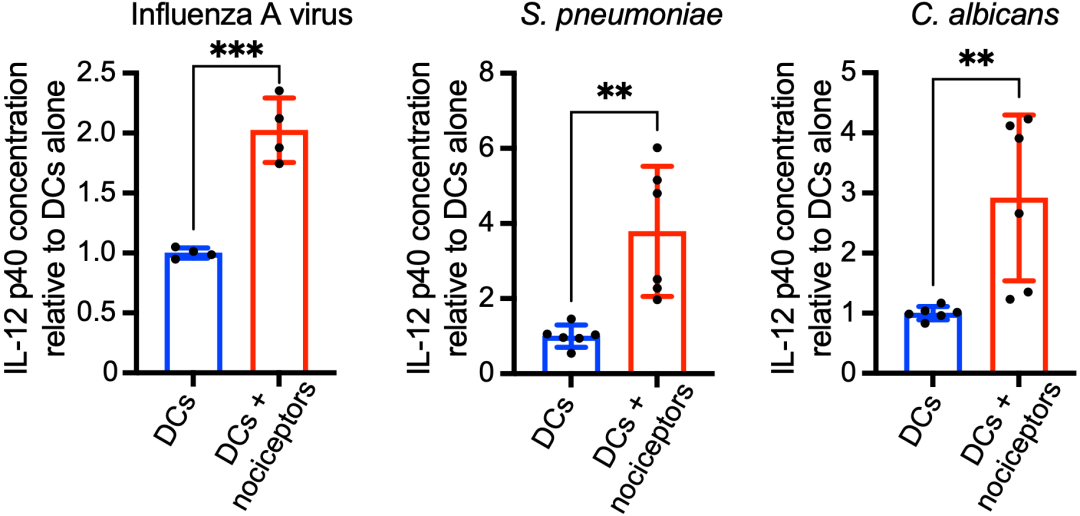
重要的是,他们还往共培养的痛觉感受器和树突状细胞中,分别加入了甲流病毒、肺炎链球菌或白色念珠菌处理了。无一例外,树突状细胞的炎症反应均增强了,表现为IL-12 p40(细胞因子IL-6、IL-12和IL-23的共同亚基)增加。这就证实了,痛觉感受器在树突状细胞调动免疫防御感染的过程中发挥着重要的作用。
病原微生物处理的影响
接下来的问题是,痛觉感受器究竟是如何调节树突状细胞的。
von Andrian团队首先在培养痛觉感受器和树突状细胞的装置中加了一层膜,这个膜允许物质交换,但是两种细胞不能直接接触。没想到这一拦截,树突状细胞对刺激因子的反应就不增强了。这就说明,物理接触是必需的。
但是在茫茫人体中,这两种细胞是如何实现近距离接触的呢?原来是痛觉感受器分泌的CCL2把树突状细胞召唤到痛觉感受器周围了。
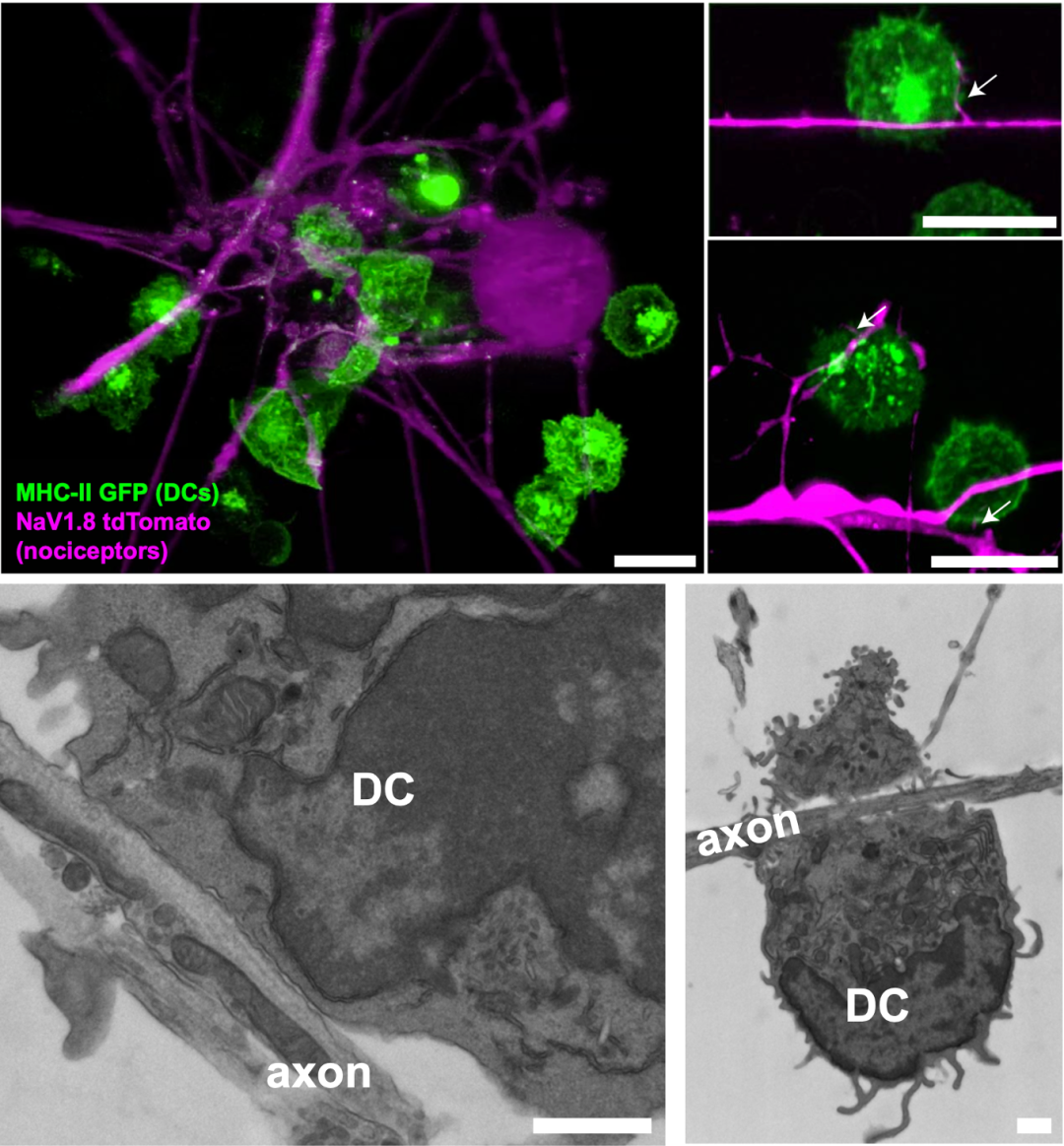
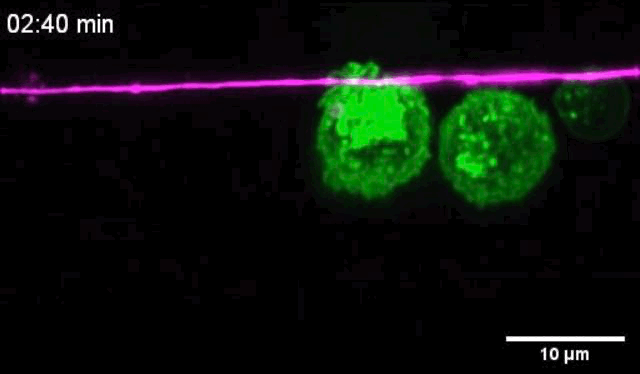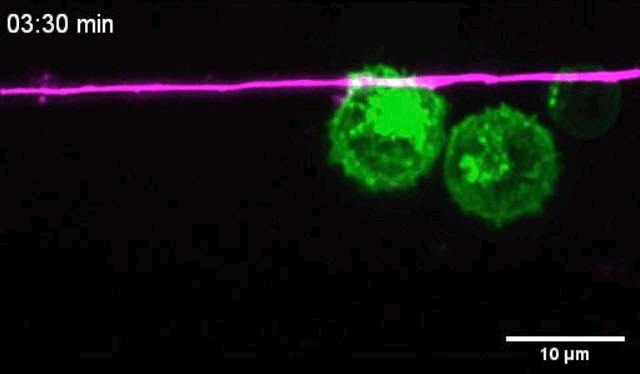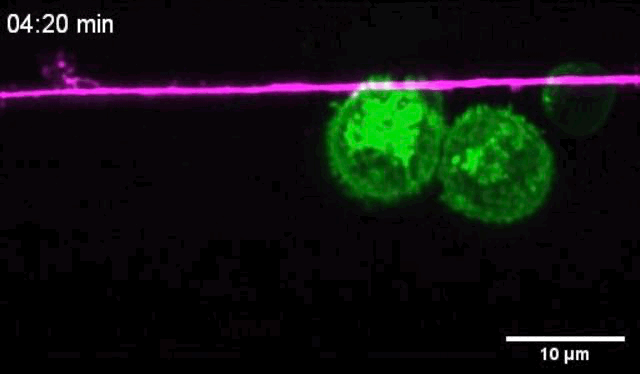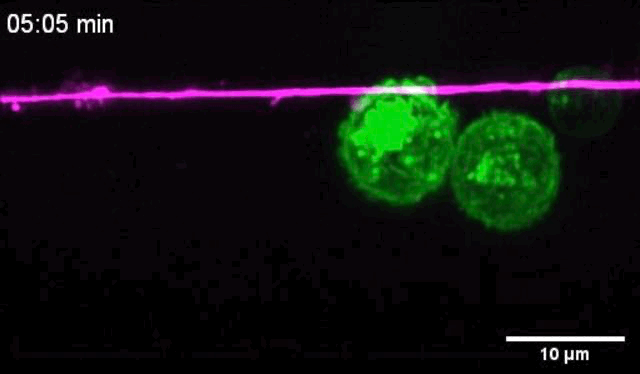
活体成像显示,树突状细胞靠近痛觉感受器之后,与痛觉感受器有亲密的接触,二者的质膜紧密贴合。
痛觉感受器和树突状细胞密切接触
让他们没想到的是,痛觉感受器与树突状细胞一接触,二者竟然会发生电耦合,痛觉感受器的动作电位会破坏树突状细胞膜的静息电位,导致树突状细胞膜去极化,离子通道打开Ca2+内流。正是这种电信号变化,增强了树突状细胞的促炎症细胞因子反应。
树突状细胞与痛觉感受器的密切接触
基于转录组测序数据,von Andrian团队发现,暴露于痛觉感受器的树突状细胞的转录组发生了深刻的变化。
尤其是在痛觉感受器分泌的神经肽——降钙素基因相关肽(CGRP)的调节下,树突状细胞哨兵功能相关蛋白的表达上升(例如pro-IL-1β),以及参与病原体抵抗、吞噬作用调节、细胞粘附和迁移、细胞因子反应性和抗原呈递的重要基因的表达也上调。
值得注意的是,以上信号的激活,并不是传统意义上的激活树突状细胞,而是使树突状细胞处于加强戒备的状态(哨兵功能增强)。
三种机制示意图
在确定了痛觉感受器在体外调节树突状细胞功能的三种不同机制后,von Andrian团队想在小鼠体内证实上述研究成果。
他们发现,与痛觉感受器耗尽的小鼠相比,IMQ刺激促进了痛觉神经元正常小鼠体内IL-12 p40的产生,以及单核细胞和中性粒细胞的浸润。除了耗尽痛觉感受器之外,麻醉剂也减少了树突状细胞IL-6的积累。
研究人员认为,痛觉感受器的消融和使用局部麻醉剂对其电活动进行沉默,会阻断痛觉感受器对树突状细胞的调节。因此,这两种方式或许可以缓解树突状细胞依赖性牛皮癣状皮肤炎症。
类似地,在小鼠体内,von Andrian团队也证实了CGRP和CCL2的功能。
总的来说,von Andrian团队这个研究明确了痛觉感受器调节树突状细胞的三个机制,基于此或许可以开发出治疗顽固性皮肤病的新药。
科学家拍下了痛觉神经元与树突状细胞互动全过程
参考文献:
[1].Pinho-Ribeiro FA, Deng L, Neel DV, et al. Bacteria hijack a meningeal neuroimmune axis to facilitate brain invasion. Nature. 2023. doi:10.1038/s41586-023-05753-x
[2].Hanč P, Gonzalez RJ, Mazo IB, et al. Multimodal control of dendritic cell functions by nociceptors. Science. 2023;379(6639). doi:10.1126/science.abm5658
[3].Baral P, Udit S, Chiu IM. Pain and immunity: implications for host defence. Nat Rev Immunol. 2019;19(7):433-447. doi:10.1038/s41577-019-0147-2
[4].Riol-Blanco L, Ordovas-Montanes J, Perro M, et al. Nociceptive sensory neurons drive interleukin-23-mediated psoriasiform skin inflammation. Nature. 2014;510(7503):157-161. doi:10.1038/nature13199
[5].Perner C, Flayer CH, Zhu X, et al. Substance P Release by Sensory Neurons Triggers Dendritic Cell Migration and Initiates the Type-2 Immune Response to Allergens. Immunity. 2020;53(5):1063-1077.e7. doi:10.1016/j.immuni.2020.10.001
欢迎您加入199IT知识星球,感谢您支持我们的发展。

2、知识星球主要以数据研究、报告分享、数据工具讨论为主;
3、加入后免费提问、免费阅读1.5万个相关数据内容,并同步海外优质数据文档;
4、每年只需199元,老用户可九折续费。
欢 迎 关 注 微 信 号 :i199IT

扫描左侧二维码或搜索添加微信公众号:i199IT
TMT最全的数据微信平台,随时随地获知有价值的数据信息
更多阅读: