爱泼斯坦-巴尔病毒(Epstein-Barr virus, EBV)很容易通过体液(主要是唾液)传播,如接吻、共用饮料或使用同一食具。因此,EBV也是最普遍的病毒之一,世界上90%以上的人口都被感染过,而且通常是在儿童时期就已经感染。
EBV导致传染性单核细胞增多症和类似疾病,不过通常没有症状。大多数感染是温和的,并会消失,但是这种病毒在体内持续存在,变得潜伏或不活跃,有时会重新激活。长期的潜伏感染与一些慢性炎症和多种癌症有关。
在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员首次描述了病毒EBV如何利用基因组的弱点来导致癌症,同时降低身体抑制它的能力。相关研究结果在线发表在Nature期刊上,论文标题为“Chromosomal fragile site breakage by EBV-encoded EBNA1 at clustered repeats”。
论文通讯作者、加州大学圣地亚哥分校医学院医学、神经科学和细胞与分子医学特聘教授Don Cleveland博士说,这些发现显示了“病毒EBV如何能够诱导人类11号染色体断裂启动一连串的基因组不稳定,从而有可能激活一个导致白血病的致癌基因并使一个主要的肿瘤抑制因子失活。这是首次证实‘脆弱DNA’位点的断裂可以被选择性地诱导。”
在每个人的基因组或全套基因中都有脆弱的位点,即在复制时更容易产生突变、断裂或缺失的特定染色体区域。有些是罕见的,有些是常见的;所有这些都与失调和疾病有关,有时一些疾病是可遗传的,有时不是,如许多癌症。
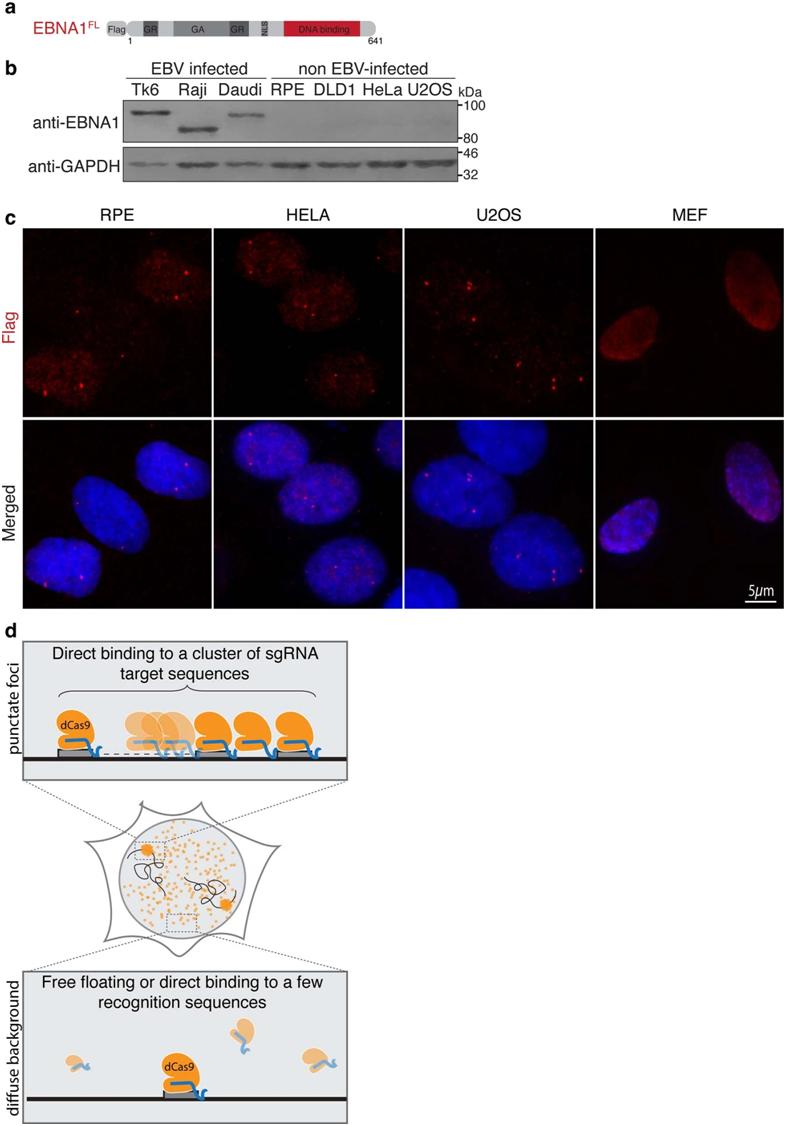
在这项新的研究中,Cleveland及其同事们重点关注EBNA1,这是一种持续存在于感染EBV的细胞中的病毒蛋白。以前已知EBNA1在EBV基因组复制起点与特定的基因组序列结合。这些作者发现EBNA1还与人类11号染色体上一个脆弱位点的EBV样序列簇结合,在这个位点上点,蛋白EBNA1的丰度增加会触发染色体断裂。
其他先前的研究已表明,EBNA1抑制p53,即一个在控制细胞分裂和细胞死亡中起关键作用的基因。在正常情形下,p53还能抑制肿瘤的形成。另一方面,p53的突变则与癌细胞生长有关。
EBNA1定位富集于内源性人类基因组中的单个基因组位点。图片来自Nature, 2023, doi:10.1038/s41586-023-05923-x。
在这项新的研究中,当这些作者研究了泛癌症全基因组分析(Pan-Cancer Analysis of Whole Genomes)项目中属于38种肿瘤类型的2439种癌症的全基因组测序数据时,他们发现携带可检测到的EB病毒的癌症肿瘤显示出更高水平的11号染色体异常,包括100%的头颈癌病例。
论文第一作者、Cleveland实验室博士后Julia Li博士说,“对于一种对大多数人类人口无害的无处不在的病毒来说,确定容易发展为潜伏感染相关疾病的高危个体仍然是一项持续的工作。这一发现表明,对EBNA1诱导的11号染色体断裂的易感性取决于对潜伏感染中产生的EBNA1水平的控制,以及每个人在11号染色体上存在的EB病毒样序列数量的遗传变异性。
展望未来,这一知识为筛选EBV相关疾病发展的风险因素铺平了道路。此外,阻断EBNA1与11号染色体上的这个序列簇的结合可以用来预防EBV相关疾病的产生。”
参考资料:
Julia Su Zhou Li et al. Chromosomal fragile site breakage by EBV-encoded EBNA1 at clustered repeats. Nature, 2023, doi:10.1038/s41586-023-05923-x.
来自: 生物谷
更多阅读: