美国贝勒医学院张翔团队近日在《细胞·干细胞》上发表的一项研究成果,让我吃惊不小。
他们发现乳腺癌或肺癌细胞分泌的外囊泡,会远程奔赴骨髓,重塑骨髓微环境,导致造血干细胞往髓源免疫抑制性细胞的方向分化,造成全身性的免疫抑制[1]。
他们不仅揭示了详细的分子机制,还基于人体数据发现:肺癌和乳腺癌对骨髓的影响非常持久,甚至在肿瘤切除后的第40周仍存在[1]。他们认为,这种持久的免疫抑制现象在一定程度上也解释了为何有些患者术后会复发。
让人欣喜的是,他们还找到了破除肿瘤持久免疫抑制、加速患者免疫恢复的方法。贝勒医学院郝晓鑫和沈一超为论文的共同第一作者。
论文首页截图
在免疫治疗时代,大家对肿瘤的免疫抑制都不陌生了。
近年来,科学家逐渐发现,肿瘤对免疫细胞的打压不仅限于肿瘤内。2018年,宾夕法尼亚大学的华人科学家Xu Xiaowei和Guo Wei团队发现,癌细胞会释放携带PD-L1的外泌体,远程压制全身T细胞[2];一年后,加州大学旧金山分校Robert Blelloch教授团队,又在肿瘤引流淋巴结和脾脏中发现了携带PD-L1的肿瘤外泌体[3]。
这些研究都是围绕PD-1/PD-L1这条通路,寻找肿瘤造成系统性免疫抑制的原因。张翔团队一直专注于癌症的骨转移以及癌症微环境。他们2021年发表的一项研究成果显示,早期的骨转移可上调乳腺癌细胞的干性特征,进而赋予这些癌细胞更强的转移能力[4]。
这一次,张翔团队将研究重点放在了骨髓来源的免疫抑制细胞上。
众所周知,肿瘤微环境中聚集了大量的髓源免疫抑制细胞。究其背后原因,主要是在肿瘤的影响下,骨髓的造血功能偏向于髓系,进而导致骨髓系细胞的积累[5]。然而,肿瘤究竟是如何远距离调控骨髓的分化方向,以及这种影响究竟有多持久,目前仍知之甚少。
张翔团队首先研究了7种乳腺癌模型和1种肺癌模型对骨髓造血的影响,发现肺癌细胞系(LLC)和富集中性粒细胞的乳腺癌亚型(例如PyMT-N)对小鼠的骨髓和外周血中髓系细胞的影响较大,因此以LLC和PyMT-N为研究对象,探索了癌细胞对骨髓的影响。
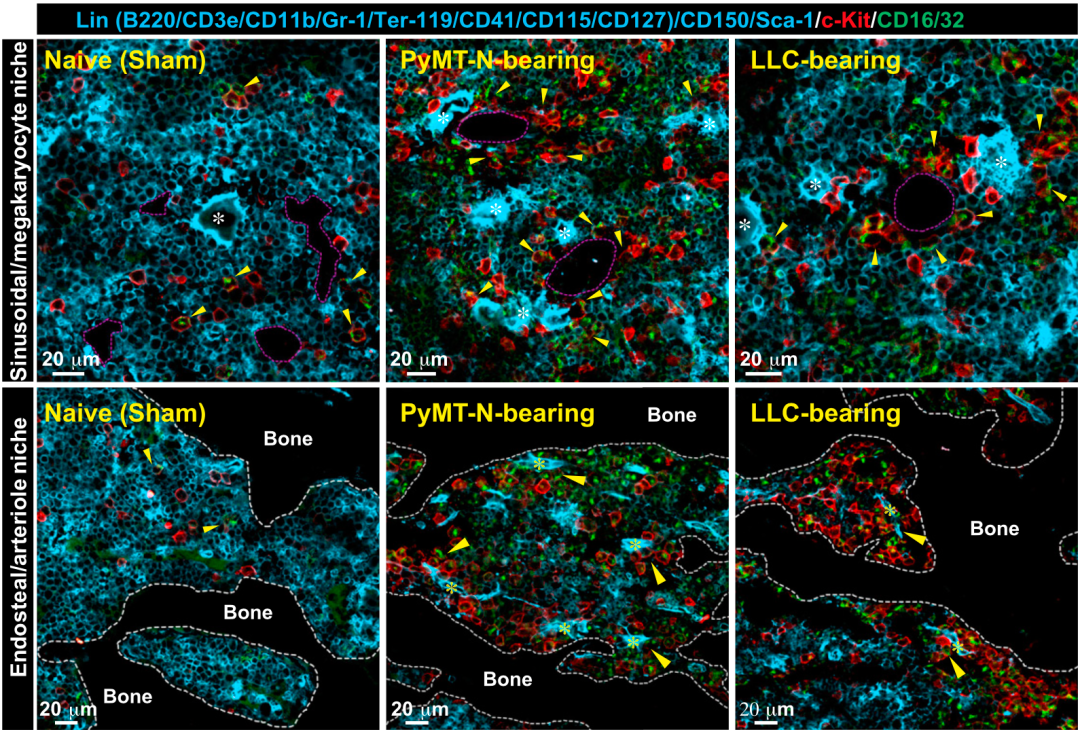
我们都知道,造血干细胞和祖细胞(HSPCs)的分化受到周围环境的严格调控。然而,在PyMT-N和LLC小鼠模型中,张翔团队发现造血干细胞错位,没有待在它该待位置,而且它的位置被CD41阴性的粒细胞-单核细胞祖细胞(GMPs)入侵,甚至完全被CD41阴性GMP取代。基于此,他们认为,这种现象就是异常造血的根源。
CD41阴性GMP的分布(黄色箭头)
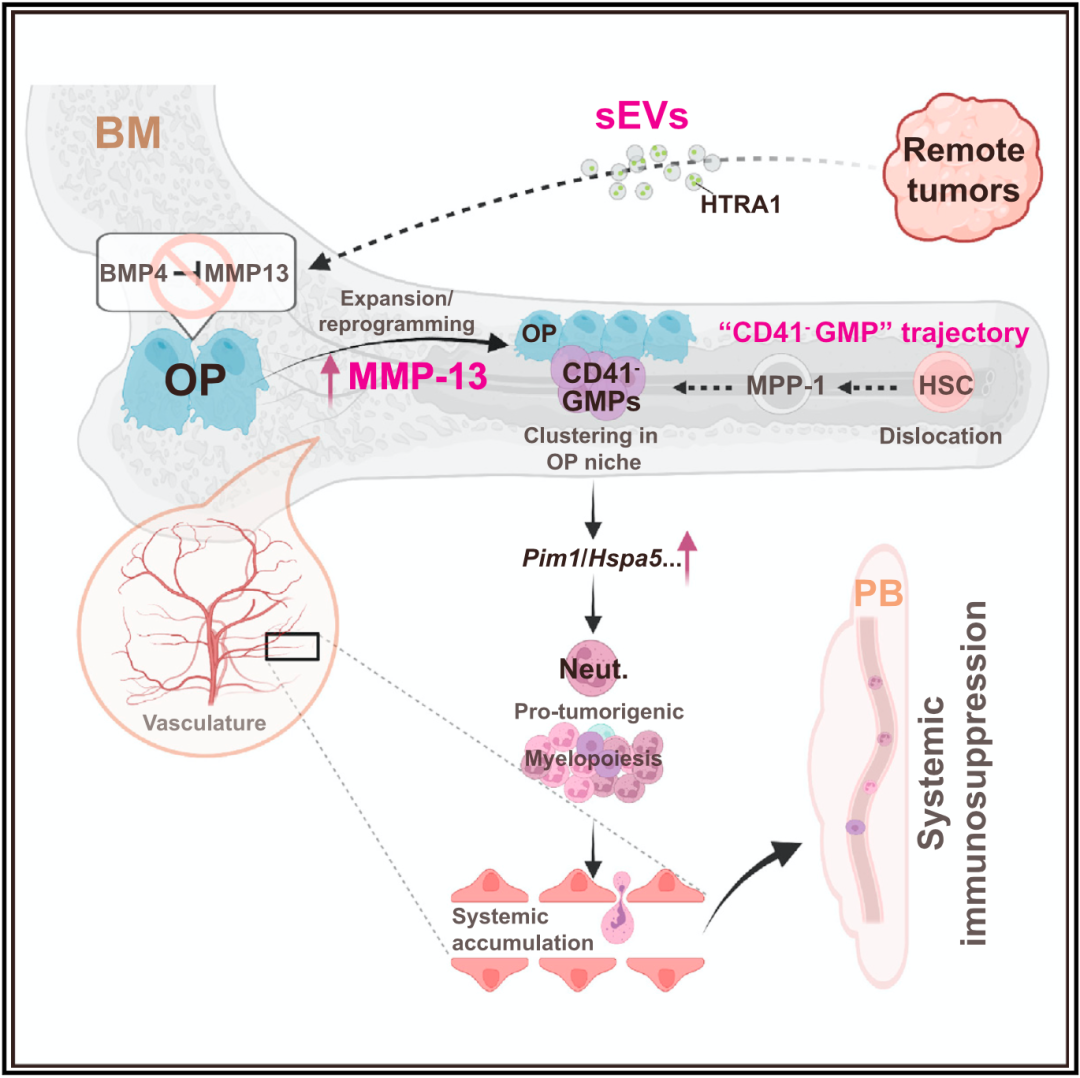
至于CD41阴性GMP大规模扩张的机制,张翔团队也做了深入的研究。
简单来说,癌细胞释放的含HTRA1外囊泡进入骨髓之后,会被骨祖细胞(OPs)吞噬,导致骨祖细胞的MMP-13表达上调,骨祖细胞的成骨分化和增殖同时增加,破坏骨髓微环境,导致造血干细胞分化成CD41阴性GMP和髓细胞过度产生。
机制示意图
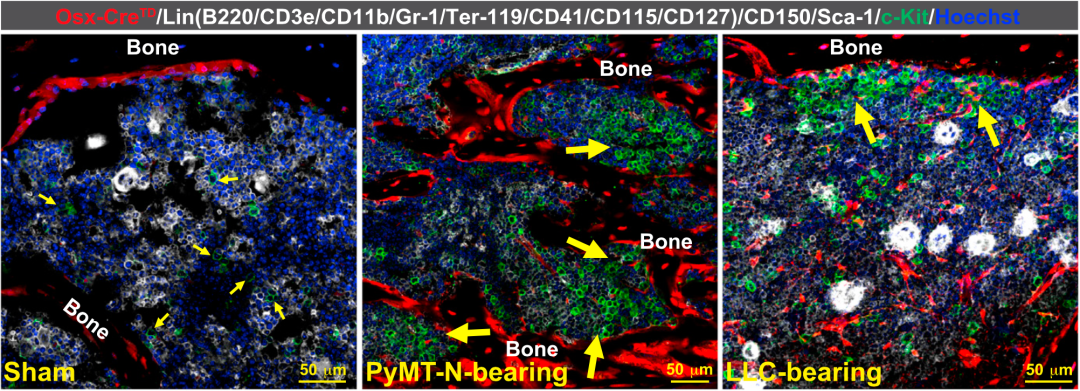
值得注意的是,张翔团队注意到,即使在PyMT-N或LLC形成的肿瘤体积小于0.2cm³的时候,也能观察到骨祖细胞的扩张。在肿瘤体积为0.2-0.3cm³时,就能观察到骨髓中存在CD41阴性GMP的扩张。
这说明,在肿瘤的早期,癌细胞就开始远程调控骨髓微环境,制造全身免疫抑制。
在肿瘤很小的时候,影响就产生了
让人感到毛骨悚然的是,肿瘤对骨髓的这种影响不仅早,而且能持续很久,哪怕肿瘤已经被切除。
张翔团队发现,即使是在小鼠接收手术切除肿瘤的45天之后,编码MMP-13的Mmp13基因仍然是骨祖细胞中上调最多的基因,而且短期造血干细胞(ST-HSCs)、多潜能祖细胞(MPPs)、GMPs和中性粒细胞仍然明显高于无瘤小鼠。
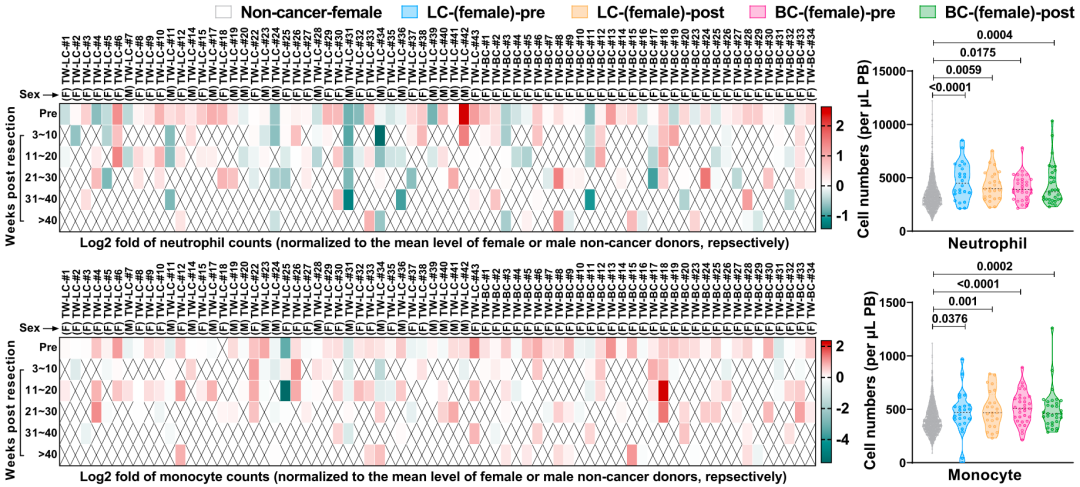
为了了解癌症患者体内是否存在类似的情况,张翔团队分析了临床样本的数据,发现与非癌症受试者相比,癌症患者(切除前)的中性粒细胞和单核细胞有所增加。让人震惊的是,乳腺癌和女性肺癌患者的中性粒细胞和单核细胞水平在肿瘤切除后长达40周的时间里处于较高的水平,不过髓系细胞没有升高;而且这种持久的效果在女性肺癌患者中似乎更为明显。
不难看出,肿瘤对骨髓微环境的破坏,不仅深刻,而且持久。
人体数据呼应小鼠研究
张翔团队既然发现了这个现象,就不可能眼睁睁看着肿瘤为非作歹而无动于衷。
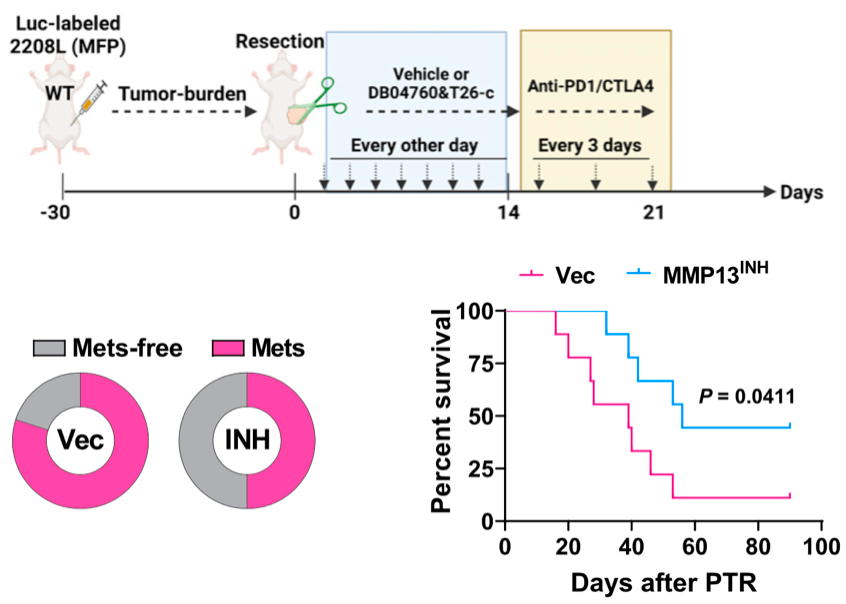
好消息是,他们发现术后用MMP-13抑制剂(CL-82198)干预,就可以恢复抗肿瘤免疫。在与免疫检查点抑制剂联用的情况下,可以降低自发性肺转移发生率,并明显改善肿瘤切除后小鼠的生存率。
小鼠的复发转移和生存都改善了
“我们的发现提出了一种新的治疗方式,与目前的策略非常不同。它不是针对癌细胞,也不是针对T细胞,它是针对整个机体。这种方式试图消除肿瘤投在整个免疫系统上的阴影。”张翔说[6]。
鉴于转移复发是癌症患者的主要死亡原因,期待张翔团队在这个研究的基础上,取得更大的突破。
参考文献:
[1].Hao X, Shen Y, Chen N, et al. Osteoprogenitor-GMP crosstalk underpins solid tumor-induced systemic immunosuppression and persists after tumor removal. Cell Stem Cell. 2023;30(5):648-664.e8. doi:10.1016/j.stem.2023.04.005
[2].Chen G, Huang AC, Zhang W, et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature. 2018;560(7718):382-386. doi:10.1038/s41586-018-0392-8
[3].Poggio M, Hu T, Pai CC, et al. Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory. Cell. 2019;177(2):414-427.e13. doi:10.1016/j.cell.2019.02.016
[4].Zhang W, Bado IL, Hu J, et al. The bone microenvironment invigorates metastatic seeds for further dissemination. Cell. 2021;184(9):2471-2486.e20. doi:10.1016/j.cell.2021.03.011
[5].Veglia F, Perego M, Gabrilovich D. Myeloid-derived suppressor cells coming of age. Nat Immunol. 2018;19(2):108-119. doi:10.1038/s41590-017-0022-x
[6].https://www.bcm.edu/news/breast-cancer-tumors-disrupt-the-immune-system-remotely-favoring-their-own-growth
来自: 奇点网
更多阅读: