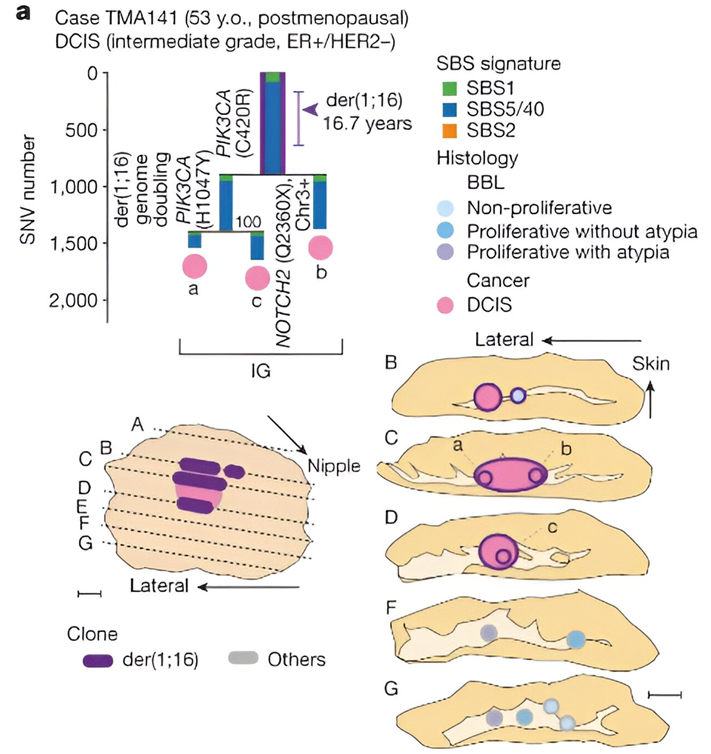
在一项新的研究中,来自日本京都大学等研究机构的研究人员重塑了关于癌症扩散的普遍假设。他们探讨了导致癌症发展的早期进化事件,以及具有共同突变的非癌症克隆(non-cancer clone)的作用。他们利用系统发育分析,追溯了乳腺癌和前体病变从获得最初的驱动基因改变到发展成临床诊断疾病的进化过程。相关研究结果于2023年7月26日在线发表在Nature期刊上,论文标题为“Evolutionary histories of breast cancer and related clones”。
近期的研究已表明携带常见癌症突变的克隆可能存在于健康组织中,这些作者希望进一步了解这些克隆演变成癌症之前的驱动事件及其发生顺序。这项新研究的重点是携带名为der(1;16)的基因改变的乳腺癌,大约20%的乳腺癌携带这种基因改变。
这些作者根据在正常上皮细胞中测得的突变率,估计了早期进化事件的大致发生时间。他们发现der(1;16)基因变异发生在青春期早期至青春期晚期。到患者30岁出头时,出现了一个共同的祖先,癌症克隆(cancer clone)和非癌症克隆都是从这个祖先演化而来的。
这些作者对从癌症和克隆相关的良性乳腺病变以及表面正常的乳腺小叶中获得的多个样本进行了全基因组测序(WGS)。他们根据从乳腺上皮建立的单细胞衍生性类器官的全基因组测序,估算了突变积累率。根据这种突变率,他们重建了包括癌症克隆和非癌症克隆在内的系统发育树,以推断乳腺癌进化的整个历史。
这些作者利用从乳腺癌患者和母乳喂养的健康志愿者的正常乳腺组织中提取的71个单细胞衍生性类器官,估算了正常乳腺上皮细胞随着年龄增长的突变积累率。这项新的研究确定了这些类器官中的体细胞突变,并分析了它们的突变率。
通过线性回归模型确定,单核苷酸变异(SNV)的数量与样本采集时的年龄、绝经后的年数、已产子女数以及是否存在驱动突变等因素有很大关系。
绝经前,SNV的累积速度为每年每个基因组 19.5 个突变,绝经后则降至每年每个基因组 8.1 个突变。每个发生怀孕达到20周的事件,突变数量就会减少54.8个,这表明生育会影响乳腺细胞的突变积累率。
der(1;16)(+)乳腺癌患者的克隆扩增。图片来自Nature, 2023, doi:10.1038/s41586-023-06333-9。
从怀孕导致月经周期中断的典型时间范围(1.1-1.5 年)来看,每个怀孕事件导致的 SNV 大量减少似乎比这些作者预期的更为显著。这可能意味着,新招募的“休眠”干细胞正在重建乳腺上皮细胞。有人提出了类似的过程,以解释支气管上皮细胞中携带香烟烟雾特征的克隆在戒烟后消失的原因。
PIK3CA突变使SNV的数量增加了210.4。PIK3CA突变可导致PI3K酶过度活跃,这可能导致癌细胞生长,并与多种器官癌症有关。
此外,还对称为插入缺失(indel)的突变进行了研究,它们的积累率在绝经后降低了45%,从每年每个基因组1.3个突变降低到每年每个基因组0.72个突变。每次分娩可使这种突变数量减少 3.9 个。
来自非癌症祖先的多个独立癌症创始细胞(cancer founder)很常见,这导致了肿瘤内的异质性。这与大多数癌症都是从单一癌症创始细胞演化而来的传统观点不同,表明来自非癌症群体的多个癌症创始细胞可能比预期的更为常见。
乳腺上皮的突变情况与其他组织不同,它更多地受到女性一生中发生的动态变化的影响,如月经周期、怀孕、分娩和哺乳。这项新的研究表明,有可能在癌症出现之前很长时间就检测到癌前克隆细胞。
参考资料:
Tomomi Nishimura et al. Evolutionary histories of breast cancer and related clones. Nature, 2023, doi:10.1038/s41586-023-06333-9.
来自: 生物谷
更多阅读: