β淀粉样蛋白(Aβ)的异常积累是阿尔茨海默病(AD)的主要病理表现之一。但AD病程漫长,在观察到Aβ沉积之前,AD已经悄悄进展多年,尽早发现AD的迹象,就能够为治疗留出足够的窗口。
近期,卡罗林斯卡学院科研团队在《分子精神病学》发表论文,研究者分析了两种APP敲入AD模式小鼠疾病进展中的基因表达变化,发现其在病理表现建立之前,表现出显著的高代谢现象,主要表现为氧化磷酸化活性上调。随后出现Aβ病理,以及后续的神经炎症、线粒体功能下降、自噬受损并最终导致突触紊乱。
研究中使用的模式小鼠分为两种,一种敲入了APP瑞典突变(KM670/671NL)和I716F突变,这使得在APP水平不变的情况下,升高Aβ42比例,导致Aβ病理。APPNL-F小鼠在9月龄左右出现Aβ病理和突触丢失,在18月龄表现出认知障碍。
另一种在前者的基础上额外敲入了北极突变(E693G),病理出现得更早。APPNL-G-F小鼠在2月龄即出现海马Aβ沉积,6月龄开始表现出记忆障碍和更明显的神经炎症。
对小鼠海马mRNA测序分析分为三个时间阶段,针对海马斑块沉积前的2-6月龄,针对淀粉样变性相关病理的6-12月龄,针对记忆障碍的12-18月龄。
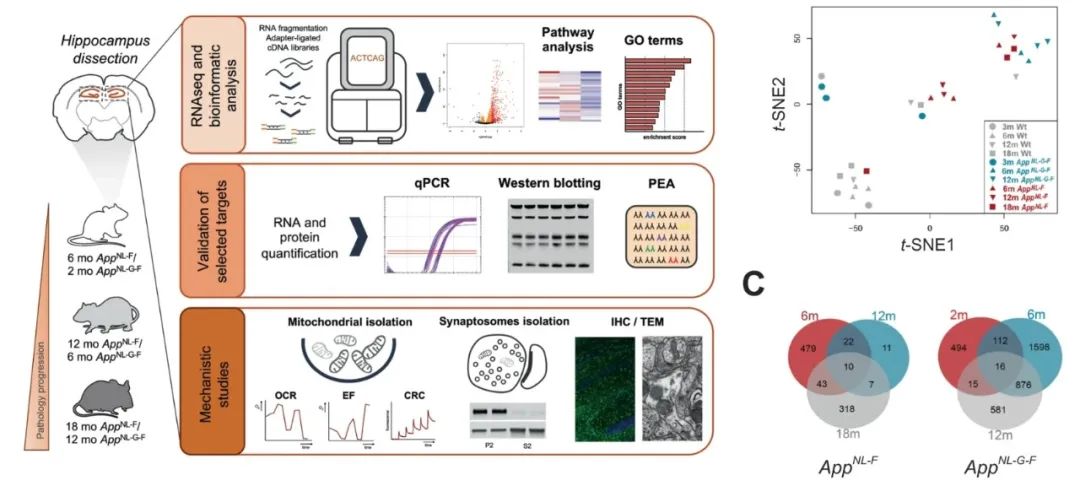
试验设计和差异表达基因数量
从图中可见,APPNL-G-F小鼠的差异表达基因(DEG)数量要多得多。
表达差异最显著的基因中,有很多参与神经炎症,例如Trem2、Ccl3、C4b、Nlrp3,以及脂质和能量代谢,例如ApoE、mt-Atp8和Cox8b。其他受影响的途径包括蛋白质稳态和合成、突触囊泡、炎症反应、细胞因子介导的信号转导等等。
有趣的是,这些途径会随着疾病的进展演变。在Aβ病理建立之后,炎症相关疾病会表现出显著的加速上调,而蛋白质加工和突触传递相关的通路下调。
研究者发现,能量相关的通路会在小鼠出现症状之前表现出总体上调,随后逐渐下调,与Aβ的细胞外积累呈负相关。
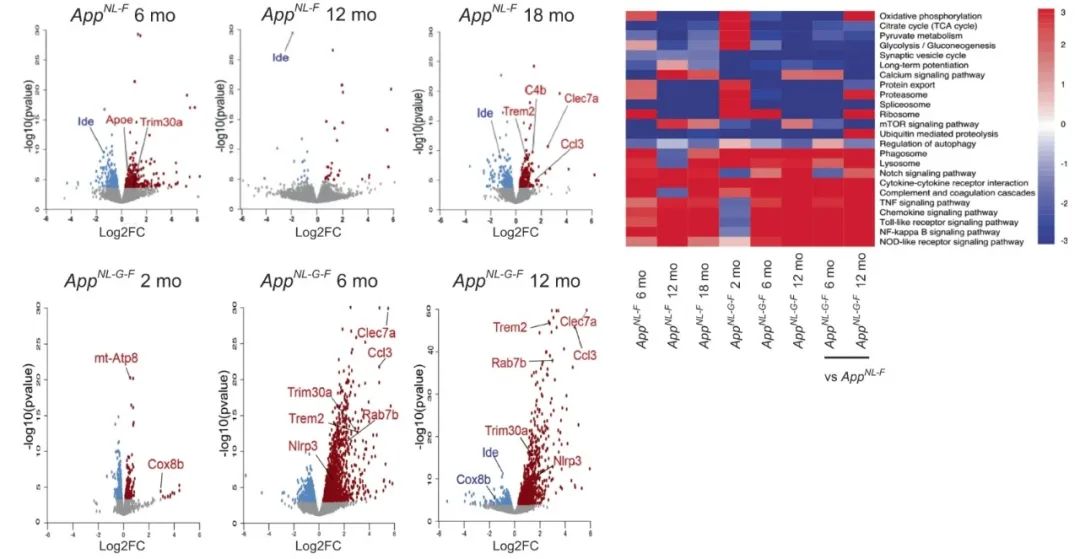
各阶段差异表达最显著的基因
mRNA测序和随后的海马转录通路分析显示,氧化磷酸化(OxPHOS)是模式小鼠早期阶段上调最多的通路之一。这与既往多组学研究中报道的线粒体功能相关共表达基因与Aβ负荷和认知能力下降相关性是一致的。
研究者分离了模式小鼠出现症状前(分别为6月龄和2月龄)的海马线粒体,分析其电子传递链(ETC),发现线粒体呼吸水平升高、产生ATP的能力增强。
此外,ETC上调增加了氧化应激的风险,小鼠线粒体活性氧水平也增加。结合Ca2+测定结果显示,两种AD模式小鼠的海马线粒体在Aβ沉积之前就出现了功能受损。
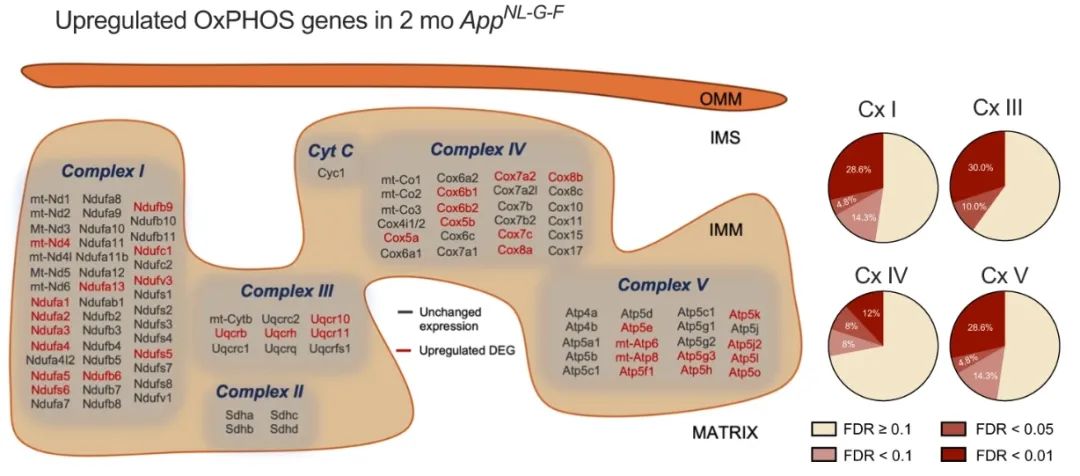
上调的氧化应激相关基因
神经炎症是AD中常见的病理表现。分析相关信号通路发现,在模式小鼠的早期阶段/症状前阶段没有观察到炎症相关的生物学过程改变,炎症级联与淀粉样变性发生阶段相近。此外,两种模式小鼠中炎症状态略有不同,炎症标志物水平变化并不一致。
在小鼠疾病的晚期,研究者观察到明显的线粒体功能障碍和突触结构紊乱。在Aβ斑块周围,可见突触前面积和突触囊泡数量明显增加,并可见自噬体的积累。
后续分析显示,自噬系统存在空间和时间依赖性的损伤。
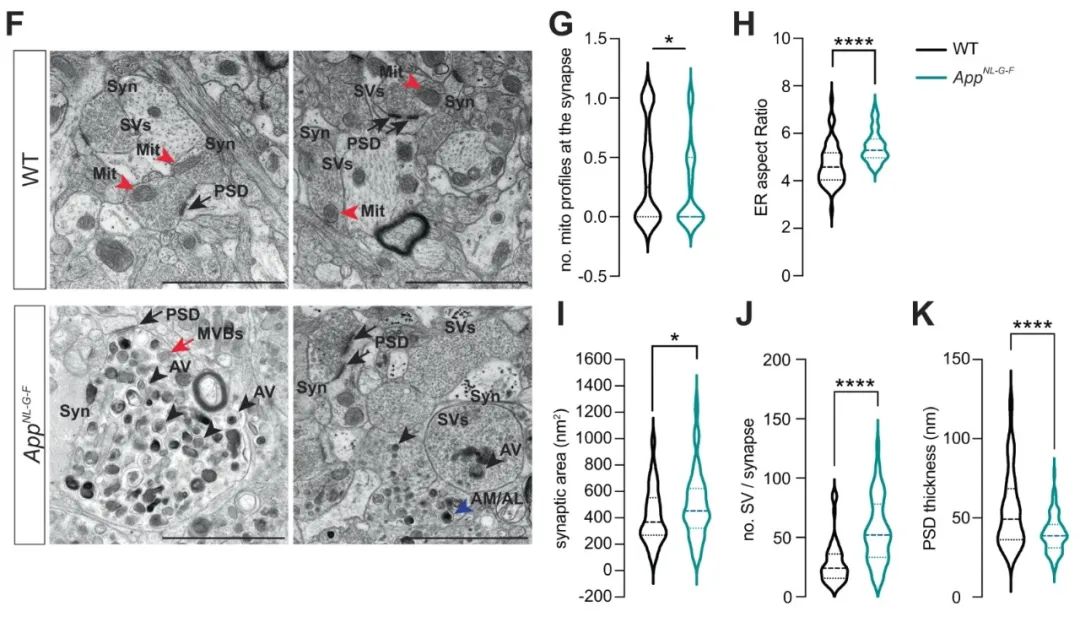
突触形态异常与线粒体丢失、囊泡增加和自噬体积累有关
这项研究通过对AD模式小鼠不同疾病阶段的分析,发现了病理进展过程中的主要转录谱变化。主要发现可以总结为以下几点:①以代谢亢进为主要特征的线粒体功能早期变化;②神经炎症的出现;③与突触前自噬损伤相关的线粒体功能下降。这些变化最终导致突触前组织的异常,并带来了随后的突触损伤和记忆力下降。
本研究为AD病理探索提供了新的时间视角,相信从中可以找到AD诊断和治疗的新思路。
参考资料:
[1]Naia, L., Shimozawa, M., Bereczki, E. et al. Mitochondrial hypermetabolism precedes impaired autophagy and synaptic disorganization in App knock-in Alzheimer mouse models. Mol Psychiatry (2023). https://doi.org/10.1038/s41380-023-02289-4
来自: 奇点神思
更多阅读:


